
为探究某铁碳合金与浓硫酸在加热条件下的反应的部分产物并测定铁碳合金中铁元素的质量分数,某化学活动小组设计了如图所示的实验装置,并完成以下实验探究。
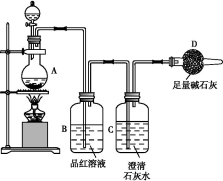
(1)往圆底烧瓶中加入m g铁碳合金,并滴入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:①常温下,Fe在浓硫酸中钝化;② 。
(2)反应一段时间后,从A中逸出气体的速率仍然较快,除因反应温度较高外,还可能的原因是 。
(3)装置B的作用是 。
(4)甲同学观察到装置C中有白色沉淀生成,他得出了使澄清石灰水变浑浊的气体是二氧化碳。装置A中能产生二氧化碳的化学方程式为 。
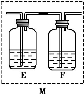
(5)乙同学认为甲同学的结论是错误的,他认为为了确认二氧化碳的存在,需在装置B-C之间添加装置M。装置E、F中盛放的试剂分别是 、 。重新实验后观察到装置F中的现象是 。
(6)有些同学认为合金中铁元素的质量分数可用KMnO4溶液来测定(5Fe2++Mn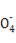 +8H+
+8H+ 5Fe3++Mn2++4H2O)。
5Fe3++Mn2++4H2O)。
测定铁元素质量分数的实验步骤如下:
Ⅰ.往烧瓶A中加入过量的还原剂使溶液中的Fe3+完全转化为Fe2+,过滤,得到滤液B;
Ⅱ.将滤液B稀释为250 mL;
Ⅲ.取稀释液25.00 mL,用浓度为c mol·L-1的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为V mL。
①步骤Ⅱ中,将滤液B稀释为250 mL需要用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还必须要用到的是 。
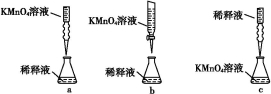
②丙同学设计了下列滴定方式(夹持仪器省略),最合理的是 (填字母序号)。
③滴定过程中 (填“需要”或“不需要”)加入指示剂。
④铁碳合金中铁元素的质量分数为 。
(1)常温下碳与浓硫酸不反应
(2)铁、碳在酸溶液中形成原电池
(3)检验SO2的存在
(4)C+2H2SO4(浓)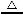 CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
(5)酸性KMnO4溶液或溴水(或其他合理答案) 品红溶液
品红溶液不褪色或无明显现象
(6)①250 mL容量瓶 ②b ③不需要 ④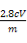 ×100%
×100%
【解析】(1)合金中碳性质不活泼,在常温下与浓硫酸不发生反应;(2)反应一段时间后,浓硫酸变成稀硫酸,铁、碳和稀硫酸发生原电池反应;(3)装置B中品红溶液用于检验反应产物SO2;(4)碳与浓硫酸在加热条件下发生氧化还原反应,化学方程式为C+2H2SO4(浓)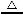 CO2↑+2SO2↑+2H2O;(5)因为SO2也能使澄清石灰水变浑浊,所以甲同学结论错误,为了确认二氧化碳存在,必须排出SO2的干扰,E中盛放酸性高锰酸钾溶液,F中盛放品红溶液,品红溶液红色不褪色,证明SO2已不存在;(6)①稀释或配制一定体积溶液必须使用相应规格的容量瓶,②酸性KMnO4溶液和酸性稀释液应使用酸式滴定管,a、c均不正确,③酸性KMnO4溶液本身为紫红色,当滴入最后一滴半分钟内不褪色,即为终点,因此不需另用指示剂,④由滴定原理n(Fe2+)=5n(Mn
CO2↑+2SO2↑+2H2O;(5)因为SO2也能使澄清石灰水变浑浊,所以甲同学结论错误,为了确认二氧化碳存在,必须排出SO2的干扰,E中盛放酸性高锰酸钾溶液,F中盛放品红溶液,品红溶液红色不褪色,证明SO2已不存在;(6)①稀释或配制一定体积溶液必须使用相应规格的容量瓶,②酸性KMnO4溶液和酸性稀释液应使用酸式滴定管,a、c均不正确,③酸性KMnO4溶液本身为紫红色,当滴入最后一滴半分钟内不褪色,即为终点,因此不需另用指示剂,④由滴定原理n(Fe2+)=5n(Mn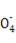 ),合金中铁的质量分数为w(Fe)=
),合金中铁的质量分数为w(Fe)=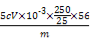 ×100%=
×100%=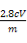 ×100%。
×100%。


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源:2014高考化学名师选择题专练 化学反应中的能量变化练习卷(解析版) 题型:选择题
如图所示,下列说法不正确的是( )
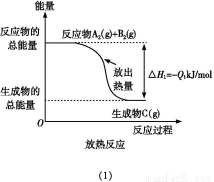

A.反应过程(1)的热化学方程式为A2(g)+B2(g)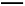 C(g)ΔH1=-Q1 kJ/mol
C(g)ΔH1=-Q1 kJ/mol
B.反应过程(2)的热化学方程式为C(g) A2(g)+B2(g)ΔH2=+Q2 kJ/mol
A2(g)+B2(g)ΔH2=+Q2 kJ/mol
C.Q1与Q2的关系:Q1>Q2
D.ΔH2>ΔH1
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师选择题专练 NA的应用练习卷(解析版) 题型:选择题
NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.0.1 mol/L的100 mL FeCl3溶液中,含有的离子数为0.04NA
B.标准状况下,将m1克锌加入m2克20%的盐酸中放出n L H2,则转移电子数为nNA/11.2
C.9 g D2O中含有的电子数为5NA
D.120 g由NaHSO4和KHSO3组成的混合物中共含有3NA的阴阳离子
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师综合题专练 有机合成与推断练习卷(解析版) 题型:填空题
化合物F首先由德国化学家合成,目前常用于制炸药、染料等。以下是其合成过程:
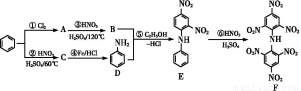
回答下列问题:
(1)化合物E的分子式是 ,化合物F的核磁共振氢谱上有 个峰。
(2)①的反应条件是 ,②的加热方式通常采用 ,④的反应类型是 。
(3)写出⑥反应的化学方程式: 。
(4)化合物G是B的同分异构体,且满足下列要求:①与B具有相同的官能团,②苯环上的一元取代产物只有两种,试写出F的结构简式 、 。
(5)已知化合物D具有弱碱性,能与盐酸反应生成盐,试写出该反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师综合题专练 化学实验练习卷(解析版) 题型:实验题
某化学兴趣小组的同学利用如图所示实验装置进行实验(图中a、b、c表示止水夹)。

请按要求填空:
(1)利用B装置可制取的气体有 (写出两种即可)。
(2)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验。
①若在丙中加入适量水,即可制得氯水。将所得氯水分为两份,进行实验Ⅰ、Ⅱ,实验操作、现象、结论如下:
实验序号 | 实验操作 | 现象 | 结论 |
Ⅰ | 将氯水滴入品红溶液 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
Ⅱ | 氯水中加入 NaHCO3粉末 | 有无色气泡产生 | 氯气与水反应的产物具有较强的酸性 |
请你评价实验Ⅰ、Ⅱ的结论是否合理?若不合理,请说明理由 。
②请利用上述装置设计一个简单的实验验证Cl-和Br-的还原性强弱(分别指出甲、乙、丙中盛装的试剂、实验现象及结论) 。
(3)B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得NO2并进行有关实验。
①B中发生反应的化学方程式为 。
②欲用D装置验证NO2与水的反应,其操作步骤如下:先关闭止水夹 ,再打开止水夹 ,使烧杯中的水进入试管丁的操作是 。
③试管丁中的NO2与水充分反应后,若向试管内缓缓通入一定量的O2,直至试管全部充满水,则所得溶液中溶质的物质的量浓度是 (气体按标准状况计算)。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师综合题专练 化学反应原理练习卷(解析版) 题型:填空题
下图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
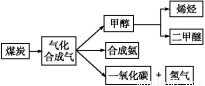
Ⅰ.已知该产业链中某反应的平衡常数表达式为:K=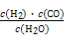 ,写出它所对应反应的化学方程式:
,写出它所对应反应的化学方程式:
。
Ⅱ.二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用。工业上以CO和H2为原料生产CH3OCH3。工业制备二甲醚在催化反应室中(压力2.0~10.0 MPa,温度230~280 ℃)进行下列反应:
①CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
ΔH1=-90.7 kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
ΔH2=-23.5 kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
ΔH3=-41.2 kJ·mol-1
(1)写出催化反应室中三个反应的总反应的热化学方程式: 。
(2)在某温度下,2 L密闭容器中发生反应①,起始时CO、H2的物质的量分别为2 mol和6 mol,3 min后达到平衡,测得CO的转化率为60%,则3 min内CO的平均反应速率为 。若同样条件下起始时CO物质的量为4 mol,达到平衡后CH3OH为2.4 mol,则起始时H2为 mol。
(3)下列有关反应③的说法正确的是 。
A.在体积可变的密闭容器中,在反应③达到平衡后,若加压,则平衡不移动、混合气体平均相对分子质量不变、混合气体密度不变
B.若830 ℃时反应③的K=1.0,则在催化反应室中反应③的K>1.0
C.某温度下,若向已达平衡的反应③中加入等物质的量的CO和H2O(g),则平衡右移、平衡常数变大
(4)为了寻找合适的反应温度,研究者进行了一系列实验,每次实验保持原料气组成、压强、反应时间等因素不变,实验结果如图,
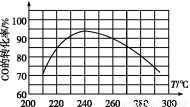
则CO转化率随温度变化的规律是 。
其原因是 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 选修3物质结构与性质练习卷(解析版) 题型:选择题
美国LawreceLiremore国家实验室(LLNL)的V.Lota.C.S.Yoo和Cynn成功地在高压下将CO2转化为具有类似SiO2结构的原子晶体,下列关于CO2的原子晶体说法中正确的是( )
A.CO2的原子晶体中存在范德华力,每1 mol CO2原子晶体中含有2NAπ键
B.在一定条件下,CO2原子晶体转化为CO2分子晶体是物理变化
C.熔点:金刚石>原子晶体CO2
D.在CO2的原子晶体中,每个C原子周围结合4个O原子,每个O原子与两个C原子相结合
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 选修2化学与技术练习卷(解析版) 题型:填空题
南海某小岛上,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示水的硬度为28°(属于硬水),主要含钙离子、镁离子、氯离子和硫酸根离子。请思考下列问题:
(1)该泉水属于 硬水(填写“暂时”或“永久”)。
(2)若要除去Ca2+、Mg2+可以往水中加入石灰和纯碱,试剂添加时先加 后加 ,原因是 。
(3)目前常用阳离子交换树脂如NaR、HR来进行水的软化,若使用HR作为阳离子交换树脂则水中的Ca2+、Mg2+与交换树脂的 起离子交换作用。若使用NaR作为阳离子交换树脂失效后可放入5%-8% 溶液中再生。
(4)岛上还可以用海水淡化来获得淡水。下面是海水利用电渗析法获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42—等离子,电极为惰性电极。请分析下列问题:
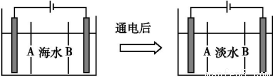
①阳离子交换膜是指 (填A或B)。
②写出通电后阳极区的电极反应式: ;阴极区的现象是: 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题6原子结构化学键练习卷(解析版) 题型:填空题
四种短周期非金属元素A、B、C、D原子序数依次增大。A是原子半径最小的元素,B原子的最外层电子数是次外层电子数的两倍,D在地壳中含量最大。请回答:
(1)B元素的原子结构示意图是
(2)化合物CA3的电子式是 ,BD2分子的结构式为
(3)丙为含有上述四种元素的常见无机酸式盐,则丙的化学式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com