
【题目】在4L恒容密闭容器中充入6mol A气体和5mol B气体,在一定条件下发生反应:3A(g)+B(g) ![]() 2C(g)+x D(g),达到平衡时,生成了2mol C,经测定D的浓度为 0.5molL﹣1,下列判断正确的是( )
2C(g)+x D(g),达到平衡时,生成了2mol C,经测定D的浓度为 0.5molL﹣1,下列判断正确的是( )
A.x=3
B.A 的转化率为 50%
C.平衡时 3V正(A)=2V逆(C)
D.达到平衡时,在相同温度下容器内混合气体的压强是反应前的95%
 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
【题目】可逆反应3A(g)![]() 3B(?)+C(?) △H>0达到化学平衡后,
3B(?)+C(?) △H>0达到化学平衡后,
(1)升高温度,用“变大”、“变小”、“不变”或“无法确定”填空。
①若B、C都是气体,气体的平均相对分子质量 ;
②若B、C都不是气体,气体的平均相对分子质量 ;
③若B是气体,C不是气体,气体的平均相对分子质量 ;
(2)如果平衡后保持温度不变,将容器体积增加一倍,新平衡时A的浓度是原来的60%,则B是 态,C是 态。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 容量瓶和分液漏斗使用前必须要检漏并干燥
B. 蒸馏操作时,温度计水银球应插入液面下
C. 检验Fe2+、Fe3+、Cl-溶液中的Fe2+,加入酸性高锰酸钾看是否褪色
D. 做过碘升华的圆底烧瓶可以用酒精洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种元素在周期表中的位置如图所示,下列说法不正确的是
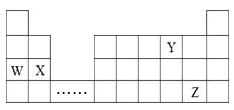
A. W、X、Y三种元素的原子半径依次减少
B. W元素的最高价氧化物的水化物的碱性比X的强
C. 可在省略号对应的族区域寻找各种优良的催化剂
D. Z元素与水反应得到HZO,HZO只有氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016广东模拟】一定条件下,乙烷发生分解反应:C2H6C2H4+H2.一段时间后,各物质的浓度保持不变,这说明( )
A.反应完全停止 B.反应达到平衡状态
C.反应物消耗完全 D.正反应速率大于逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在一恒容容器中进行的可逆反应A2(s)+3B2(g) ![]() 2AB3(g)达到平衡的标志是
2AB3(g)达到平衡的标志是
A.容器内每减少1mol A2,同时生成2mol AB3
B.容器内每减少1mol A2,同时消耗3mol B2
C.混合气体总的物质的量不变
D.容器内的气体密度不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室制备乙酸乙酯的化学方程式如下:CH3COOH+C2H5OH![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O

(1)该反应的平衡常数表达式K=____________________。
(2)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用如图所示装置进行了以下4个实验。实验开始先用酒精灯微热3 min,再加热使之微微沸腾3 min。实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如下:
实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 测得有机层的厚度/cm |
A | 3 mL乙醇、2 mL乙酸、1 mL 18 mol·L-1浓H2SO4 | 饱和Na2CO3溶液 | 5.0 |
B | 3 mL乙醇、2 mL乙酸 | 0.1 | |
C | 3 mL乙醇、2 mL乙酸、6 mL 3 mol·L-1 H2SO4 | 1.2 | |
D | 3 mL乙醇、2 mL乙酸、盐酸 | 1.2 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是____________mL和____________mol·L-1。
②分析实验____________(填实验编号)的数据,可以推测出浓H2SO4的吸水性,提高了乙酸乙酯的产率。浓H2SO4的吸水性能够提高乙酸乙酯产率的原因是__________________。
③加热有利于提高乙酯乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有48.4g碱式碳酸镁样品(化学式:xMgCO3·yMg(OH)2·zH2O,x、y、z为正整数),将其分为二等份,一份样品充分灼烧至恒重进行热重分析,结果如图所示。另一份投入150mL某溶液的盐酸中,充分反应后生成CO24.48L(已知算成标准状况下),所得溶液稀释至250mL,测得溶液的c(H+)=0.100mol/L。

按要求回答下列问题:
(1)盐酸的物质的量浓度c(HCl)=______mol/L
(2)x:y:z=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子,在碱性溶液中能大量共存,且溶液为无色透明的是( )
A.K+ MnO4﹣ Cl﹣ SO42﹣
B.Na+ Ba2+ NO3﹣ Cl﹣
C.Na+ SO42﹣ Cu2+ Cl﹣
D.Na+ H+ NO3﹣ SO42﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com