
【题目】氮的循环在自然界元素的循环中具有重要的意义,有些氮的转化是从氮气转化为含氮的化合物,有的转化发生在含氮的化合物之间。下列过程中,以游离态的氮为原料,最终产生含氮的化合物的是( )
A.汽车尾气中的氮氧化物形成酸雨B.硝化细菌的硝化过程
C.动物尸体腐烂D.豆科植物的根瘤菌固氮
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】为探究某固体氧化物A(仅含两种元素)的组成和性质,设计并完成如下实验,。请回答:

(1)固体A的化学式______________。
(2)单质B在氯气中反应的现象_______________________________。
(3)写出C→D在溶液中发生氧化还原反应的离子方程式_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项中的反应、现象与结论完全一致的是(夹持、加热装置已略去)

①中的反应 | ②中的现象 | 结论 | |
A | MnO2与浓盐酸加热 | KI淀粉溶液很快变蓝 | Cl2有氧化性 |
B | Cu与浓硫酸加热 | 溴水褪色 | SO2有漂白性 |
C | Na2CO3与醋酸溶液 | 苯酚钠溶液变浑浊 | 酸性:碳酸>苯酚 |
D | 电石与饱和食盐水 | 酸性高锰酸钾溶液褪色 | 乙炔有还原性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 X、Y、Z 的单质 m、n、p 在通常状况下均为气态双原子分子,其中 m 含共用电子对数最多;甲、乙分别为 10 电子、18 电子分子,它们的转化关系如下图所 示(反应条件略去)。下列说法正确的是
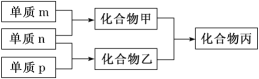
A. X 是同周期中非金属性最强的元素
B. 元素 X、Y、Z 的原子半径大小关系为 X<Y<Z
C. Z 的氧化物对应的水化物的酸性在主族元素中最强
D. 化合物丙是离子化合物,既含离子键又含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学反应与能量的说法正确的是( )
A.古文说“冰,水为之,而寒于水”说明等量的水和冰相比,冰的能量更高
B.化学反应遵循质量守恒定律的同时,也遵循能量守恒定律
C.已知C(石量,s)=C(金刚石,s) H>0,则金刚石比石墨稳定
D.任何化学反应都伴随着能量变化,其表现形式只有吸热和放热两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸镍[Nix(OH)y(CO3)z·nH2O]是一种绿色粉末,常用作催化剂和陶瓷着色剂,300 ℃以上时分解生成 3 种氧化物。为确定其组成,某同学在实验室进行了有关的探究。 请回答下列问题:
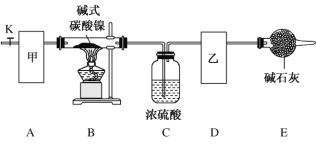
(1)装置 E 中仪器的名称是_____。
(2)甲、乙两装置可分别选取下列装置_____、_____(填字母,装置可重复选取)。

(3) 安装好实验仪器,检查装置气密性;称取一定量的碱式碳酸镍样品,放入硬质玻璃管内; 加热硬质玻璃管,当装置 C 中_____(填实验现象)时,停止加热;打开活塞 K,缓缓通入一段时间空气后,结束实验。
(4)装置 A 的作用是______________________________________________________________________。
(5)实验前后测得下表所示数据:
装置 B 中样品质量/g | 装置 C 质量/g | 装置 D 质量/g | |
实验前 | 3.77 | 132.00 | 41.00 |
实验后 | 2.25 | 133.08 | 41.44 |
已知碱式碳酸镍中 Ni 化合价为+2 价,则该碱式碳酸镍的化学式为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“碳捕捉技术”是指通过一定的方法,将工业生产中产生的CO2分离出来进行储存利用。利用NaOH溶液来“捕捉”CO2的过程如图所示(部分条件及物质未标出)。

下列说法错误的是
A. 能耗大是该方法的一大缺点
B. 整个过程中,有2种物质可以循环利用
C. “反应、分离”环节中,有复分解反应发生
D. “反应、分离”环节中,分离的基本操作是蒸发、结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某磁黄铁矿的主要成分是FexS(S为-2价),既含有Fe2+,又含有Fe3+,将一定量的该磁黄铁矿与100mL的盐酸恰好完全反应(注:矿石中其他成分不与盐酸反应),生成2.4g硫单质,0.425mol FeCl2 和一定量H2S气体,且溶液中无Fe3+。则下列说法正确的是
A. 该盐酸的物质的量浓度为4.25mol·L-1
B. 该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为3∶1
C. 成的H2S气体在标准状况下的体积为2.24L
D. 该磁黄铁矿中FexS的x=0.85
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com