
| H2SO4 |
| △ |
科目:高中化学 来源:不详 题型:单选题
| A.某饮用矿物质水,水桶上标注矿物质含量:钠 2.0-3.0mg/L;钾0.04-0.1mg/L;钙 0.2-1mg/L;镁 0.4-1mg/L.其中的钠含量是指氯化钠的含量 |
| B.水是由一个氧原子和两个氢原子组成的 |
| C.二氧化碳是由碳、氧两种元素组成的 |
| D.含有氧元素的化合物是氧化物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.14C与14N互为同位素 |
| B.葡萄糖与果糖互为同分异构体 |
| C.H2与CH4互为同系物 |
| D.SO2与SO3互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.O2、O3互为同位素 |
| B.1H、2H、3H、H+、H2是氢元素形成的五种不同粒子 |
| C.正丁烷和异丁烷互为同系物 |
| D.乙烷、乙烯互为同分异构体 |
查看答案和解析>>
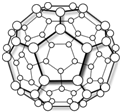
科目:高中化学 来源:不详 题型:单选题
| A.C60是碳的一种同素异形体 |
| B.C60是一种新型的化合物,有着重要的应用 |
| C.C60分子的摩尔质量为720 |
| D.C60的相对分子质量为720g/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com