
下列离子方程式正确的是
A.向CaCl2溶液中通入CO2:Ca2++CO2+H2O=CaCO3↓+2H+
B.漂白粉溶液中通入过量SO2:ClOˉ+H2O+SO2=HSO +HClO
+HClO
C.在FeSO4溶液中加入H2O2溶液:Fe2++2H2O2+4H+=Fe3++4H2O
D.在澄清石灰水中加入少量小苏打溶液:Ca2++OHˉ+HCO =CaCO3↓+H2O
=CaCO3↓+H2O
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源:2015-2016学年黑龙江省高一上期中测试化学试卷(解析版) 题型:选择题
粗盐中含可溶性CaCl2、MgCl2及Na2SO4,除去这些杂质的试剂可选用①Na2CO3、②NaOH、③BaCl2、④HCl,加入的先后顺序可以是
A.①②③④ B.②③①④ C.②①③④ D.①③②④
查看答案和解析>>
科目:高中化学 来源:2016届广西省高三上学期第二次月考化学试卷(解析版) 题型:填空题
Cl2及其化合物在生产、生活中具有广泛的用途。

(1)25℃时将氯气溶于水形成氯气-氯水体系,该体系中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。
①已知HClO的杀菌能力比ClO-强,由图分析,用氯气处理饮用水时,pH=7.5与 pH=6时杀菌效果强的是__________;
②氯气-氯水体系中,存在多个含氯元素的平衡关系,分别用平衡方程式表示为__________________。
(2)①ClO2是一种新的消毒剂,工业上可用Cl2氧化NaClO2溶液制取ClO2,写出该反应的化学方程式________ ;
②工业上还可用下列方法制备ClO2,在80℃时电解氯化钠溶液得到NaClO3,然后与盐酸反应得到ClO2。电解时,生成ClO3–的电极反应式为 。
(3)一定条件下,在水溶液中 1 mol Cl–、1mol ClOx–(x=1,2,3,4)的能量大小与化合价的关系如图所示
①从能量角度看,C、D、E中最不稳定的离子是 (填离子符号);
②B → A + D反应的热化学方程式为 (用离子符号表示)。
查看答案和解析>>
科目:高中化学 来源:2016届广西省高三上学期第二次月考化学试卷(解析版) 题型:选择题
化学与生产、生活密切相关。下列说法不正确的是
A.闻名世界的中国陶瓷、酿酒、造纸技术都充分应用了化学工艺
B.四大发明之一黑火药是由硫黄、硝石、木炭三种物质按一定比例混合制成
C.侯氏制碱法的工艺过程中应用了物质溶解度的差异
D.打磨磁石制作指南针为化学变化
查看答案和解析>>
科目:高中化学 来源:2016届河南省南阳市高三上学期第一次联考化学试卷(解析版) 题型:选择题
下列组合①氯化铝和氢氧化钠 ②四羟基合铝酸钠和盐酸 ③盐酸和碳酸钠 ④硝酸银和氨水中,因加入的顺序不同,现象不同是
A.①② B.①②③ C.①②④ D.全部
查看答案和解析>>
科目:高中化学 来源:2016届河南省南阳市高三上学期第一次联考化学试卷(解析版) 题型:选择题
下列有关阿伏加德罗常数(NA)的叙述正确的是
A.常温常压下,32克氧气中含有2NA个原子
B.标准状况下,1L己烯完全燃烧后所生成气态产物的分子数为6NA/22.4
C.78g Na2O2晶体中含有的阴离子数目为2NA个
D.1molNa2O2与足量CO2反应转移的电子总数为2NA
查看答案和解析>>
科目:高中化学 来源:2016届山东省淄博市高三上学期第一次月考化学试卷(解析版) 题型:实验题
三氯化磷(PCl3)是一种重要的掺杂剂。实验室要用黄磷(即白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如下图所示:(部分夹持装置略去)
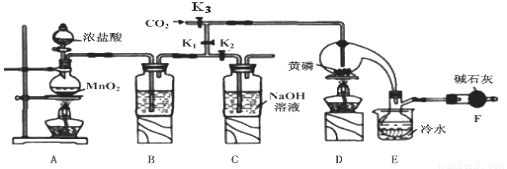
已知:①黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5 ;
②PCl3遇水会强烈水解生成 H3PO3和气体;
③PCl3遇O2会生成POCl3,POCl3溶于PCl3;
④PCl3、POCl3的熔沸点见下表:
物质 | 熔点/℃ | 沸点/℃ |
PCl3 | -112 | 75.5 |
POCl3 | 2 | 105.3 |
请回答下列问题:
(1)B中所装试剂是 ;
E中冷水的作用是 。
(2)F中碱石灰的作用是 。
(3)实验时,检查装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷。通干燥CO2的作用是 。
(4)粗产品中常含有POC13、PCl5等。加入黄磷加热除去PCl5后,通过 (填实验操作名称),即可得到较纯净的PCl3。
(5)实验结束时,可以利用C中的试剂吸收多余的氯气,C中反应的离子方程式为 。
(6)通过下面方法可测定产品中PCl3的质量分数:
①迅速称取1.00 g产品,加水反应后配成250 mL溶液;
②取以上溶液25.00mL,向其中加入10.00 mL 0.1000 mol/L碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000 mol/L的Na2S2O3,溶液滴定;
④重复②、③操作,平均消耗0.1000 mol/L Na2S2O3溶液8.40mL。
已知:H3PO3+I2=H3PO4+2HI,I2+2Na2S2O3=2NaI+Na2S4O6,根据上述数据,假设测定过程中没有其他反应,该产品中PCl3的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2016届四川省广元市高三上学期第二次阶段测理综化学试卷(解析版) 题型:填空题
某小组同学设想用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾。
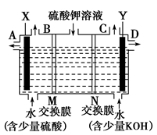
(1)X极与电源_________(填“正”或“负”)极相连,氢气从_________(填 “B” 或“C” )口导出。
(2)离子交换膜只允许一类离子通过,则M为__________交换膜(填“阴离子”或“阳离子”,下同),N为_________交换膜。
(3)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池(石墨为电极),则电池负极的电极反应式为_____________________。
(4)若在标准状况下,制得11.2 L氢气,则生成硫酸的质量是_________,转移的电子数为________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高二上学期期中测试化学试卷(解析版) 题型:选择题
反应A(s)+2B(g) 2C(g)在一密闭容器中进行,当改变下列条件之一时,一定能增大反应速率的是
2C(g)在一密闭容器中进行,当改变下列条件之一时,一定能增大反应速率的是
A.增加A物质的量 B.降低温度
C.压缩反应容器体积 D.消耗掉部分B物质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com