
| A. | 2H2(g)+O2(g)═2H2O(l);△H=-142.9kJ/mol | B. | 2H2(g)+O2(g)═2H2O(l);△H=-571.6kJ/mol | ||
| C. | 2H2+O2═2H2O;△H=-571.6kJ/mol | D. | 2H2(g)+O2(g)═2H2O(l);△H=+571.6kJ/mol |
分析 25℃、101kPa下,1g氢气完全燃烧生成液态水时放出热量142.9kJ,则4g氢气燃烧生成液态水,放出571.6kJ热量,热化学方程式应为2H2(g)+O2(g)═2H2O(1)△H=-571.6 kJ•mol-1,以此解答该题.
解答 解:已知1g氢气燃烧生成液态水放出142.9kJ的热量,4g氢气燃烧生成液态水,放出571.6kJ热量,
A、4g氢气燃烧生成液态水,放出热量571.6kJ,不是142.9kJ,同时物质聚集状态未标注,故A错误;
B、4g氢气燃烧生成液态水,放出热量571.6kJ,故B正确;
C、4g氢气燃烧生成液态水,放出571.6kJ热量,放热时焓变值为负值,需要物质聚集状态标注,故C错误;
D、4g氢气燃烧生成液态水,放出热量571.6kJ,放热时焓变值为负值,故D错误;
故选B.
点评 本题主要考查热化学方程式的书写方法及系数的含义,注意焓变的正负和物质的状态,掌握基础是解题关键,题目较简单.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:选择题
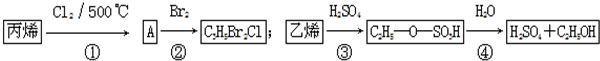
| A. | 反应①与反应④均是取代反应 | |
| B. | 反应②与反应③均是加成反应 | |
| C. | 反应②中产物的结构简式为CH2BrCH2CHClBr | |
| D. | 反应③、④表明硫酸是乙烯与水反应的催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阳极反应:Fe-2e-═Fe2+ | |
| B. | 阴极反应:2H++2e-═H2↑ | |
| C. | 在电解过程中工业废水由酸性变为碱性 | |
| D. | 可以将铁电极改为石墨电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
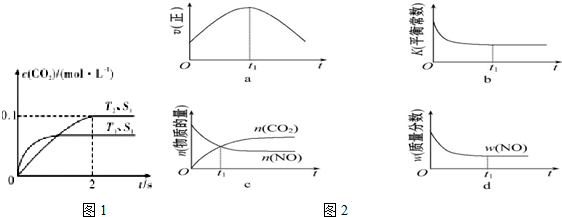
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. 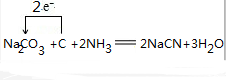 .
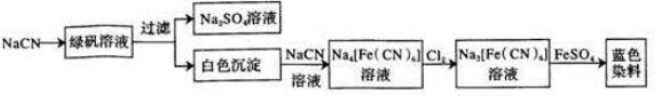
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com