

分析 (1)反应能自发进行,应满足△H-T•△S<0;
(2)表示平衡常数Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量的浓度c(B),可根据平衡常数的表达式书写,平衡常数等于气体生成物浓度幂之积除以气体反应物浓度幂之积;
(3)反应Ⅰ为吸热反应,反应Ⅱ为放热反应,结合反应物与生成物总能量大小之间的关系判断;
(4)反应Ⅰ生成SO2和CO2,反应Ⅱ只生成CO2,如同时发生,则两种气体的浓度比会随时间发生变化;
(5)由反应Ⅰ可知生成二氧化硫的反应为吸热反应,则低温下不利于生成二氧化硫;
(6)①依据热化学方程式和盖斯定律计算得到CH4(g)催化还原NO(g)生成N2(g)、CO2(g)和H2O(l)的热化学方程式;
②依据原电池的构成原理,下列化学反应在理论上可以设计成原电池需要是自发进行的氧化还原反应;只有D符合;在酸溶液中甲烷燃料电池中燃料在负极发生氧化反应,氧气在正极得到电子发生还原反应生成二氧化碳和水;
解答 解:(1)反应Ⅰ吸热,则△H>0,由方程式可知△>0,反应能自发进行,应满足△H-T•△S<0,则应在较高温度下进行,故答案为:较高温度下;
(2)由题意可知,反应Ⅱ的Kp=$\frac{{P}^{4}(C{O}_{2})}{{P}^{4}(CO)}$,故答案为:$\frac{{P}^{4}(C{O}_{2})}{{P}^{4}(CO)}$;
(3)反应Ⅰ为吸热反应,反应Ⅱ为放热反应,则A、D错误;反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则反应Ⅱ的活化能较大,则B错误、C正确,
故答案为:C;
(4)反应Ⅰ生成SO2和CO2,反应Ⅱ只生成CO2,如同时发生,则两种气体的浓度比随时间会发生变化,有无二氧化硫可知反应I是否发生,如c(CO2)=c(SO2),则反应II未发生,如c(CO2)>c(SO2),则反应同时发生,
故答案为:有无二氧化硫可知反应I是否发生,如c(CO2)=c(SO2),则反应II未发生,如c(CO2)>c(SO2),则反应同时发生;
(5)A.向该反应体系中投入石灰石,可使更多的二氧化硫转化为硫酸钙,减少二氧化硫的排放,故A正确;
B.由反应Ⅰ可知生成二氧化硫的反应为吸热反应,则低温下不利于生成二氧化硫,则应在合适的温度区间内控制较低的反应温度,故B正确;
C.由图象可知,提高CO的初始体积百分数,增大CaS的质量分数,减少二氧化硫的排放,故C正确;
D.提高反应体系的温度,不利于二氧化硫的减少,故D错误.
故答案为:ABC;
(6)①Ⅰ.CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(l)△H=-955kJ•mol-1
Ⅱ.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3l kJ•mol-1
Ⅲ.2NO(g)+O2(g)═2NO2(g)△H=-112.97kJ•mol-1
依据热化学方程式和盖斯定律计算(Ⅰ+Ⅲ)×2-Ⅱ得到反应的热化学方程式为:CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(l)△H=-1245.63 kJ/mol,
故答案为:CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(l)△H=-1245.63 kJ/mol;
②设计成原电池需要是自发进行的氧化还原反应;
A.C(s)+CO2(g)=2CO(g)是非自发进行的氧化还原反应,故A不选;
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l),反应是复分解反应,不是氧化还原反应,故B不选;
C.2H2O(l)=2H2(g)+O2(g),反应是非自发进行的氧化还原反应,故c不选;
D.CH4(g)+2O2(g)=CO2(g)+2H2O(l),是自发进行的氧化还原反应,可以设计成原电池,故D选;
D反应是甲烷燃料电池,在酸溶液中甲烷燃料电池中燃料在负极发生氧化反应,氧气在正极得到电子发生还原反应;
负极电极反应为:CH4-8e-+2H2O=CO2+8H+,正极电极反应为:O2+4H++4e-=2H2O;
故答案为:D,O2+4H++4e-=2H2O;
点评 本题涉及化学平衡影响因素、反应热与焓变、原电池原理的考查,侧重于学生的分析能力和计算能力的考查,题目较为综合,涉及面广,题目难度中等.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:选择题
| A. | 100mL 1mol•L-1的NaCl溶液 | B. | 150mL 1mol•L-1的MgCl2溶液 | ||
| C. | 200mL 1mol•L-1的HCl溶液 | D. | 10mL 1mol•L-1的AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
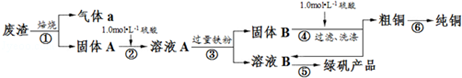

| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.90 | 20.02 | 19.98 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
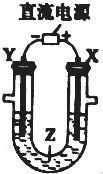
| A. | 氯碱工业中,X电极上反应式是4OH--4e-═2H2O+O2↑ | |
| B. | 电解精炼铜时,Z溶液中的Cu2+浓度变小 | |
| C. | 制取金属镁时,Z是熔融的氧化镁 | |
| D. | 在铁片上镀铜时,Y是纯铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤⑥⑦⑧ | B. | ④⑤⑧ | C. | ④⑤⑦⑧ | D. | ③④⑤⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
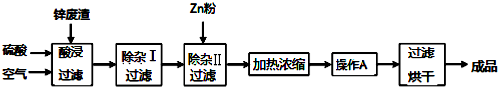
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Zn(OH)2 | Cu(OH)2 |
| 开始沉淀的 pH | 3.3 | 1.5 | 6.5 | 5.4 | 4.2 |
| 沉淀完全的 pH | 5.2 | 3.7 | 9.7 | 8.0 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 我们使用合金是因为它比纯金属具有更优良的化学性质 | |
| B. | 钢化玻璃、有机玻璃、防弹玻璃均属于硅酸盐材料 | |
| C. | 高分子材料可能在特殊情况导电,如聚乙炔 | |
| D. | 可用作荧光灯内壁保护层的纳米氧化铝属于胶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com