
| A. | FeCl3 | B. | MgCl2 | C. | AlCl3 | D. | ZnCl2 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| 温度/°C | K1 | K2 |
| 500 | 1.00 | 3.15 |
| 700 | 1.47 | 2.26 |
| 900 | 2.40 | 1.60 |
| A. | 若500℃时进行反应①,则CO2转化率为50% | |
| B. | 900℃进行反应③H2(g)+CO2(g)?H2O(g)+CO(g),其平衡常数K3为=1.50 | |
| C. | 反应①的焓变△H>0,反应②的焓变△H<0 | |
| D. | 反应①平衡体系中通入CO2,在温度不变的条件下,平衡正向移动,达到新平衡时CO2的转化率比原平衡小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 萃取操作震荡时,用右手压住分液漏斗口部,用左手握住活塞部分 | |
| B. | 蒸馏操作时,冷却水应从冷凝管的下口进,上口出 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 萃取操作选择有机萃取剂时,萃取剂的密度必须比水大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
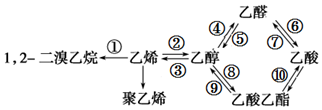
| A. | 反应①是加成反应,产物的结构简式 CH3CHBr2 | |
| B. | 反应②④⑥是氧化反应,其中④是去氢氧化 | |
| C. | 反应⑦⑧⑨⑩是取代反应,其中⑧是酯化反应 | |
| D. | ③是消去反应,反应的副产物中有SO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.45mol/L | B. | 0.5mol/L | C. | 0.6mol/L | D. | 0.55mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸工业中,增大O2的浓度有利于提高SO2的转化率 | |
| B. | 开启啤酒瓶后,瓶中立刻泛起大量泡 | |
| C. | 对2HI(g)?H2(g)+I2(g)平衡体系增加压强使颜色变深 | |
| D. | 滴有酚酞的氨水溶液,适当加热溶液(氨气不挥发)后颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com