
下列说法正确的是( )
| A.摩尔是七个基本物理量之一 |
| B.1mol氢 |
| C.摩尔是表示物质的数量单位 |
| D.每摩尔物质都含有阿伏加德罗常数个指定微粒 |
科目:高中化学 来源: 题型:单选题
已知:2Fe+3Cl2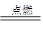 2FeCl3,下列说法正确的是(设nA为阿伏加德罗常数的数值)
2FeCl3,下列说法正确的是(设nA为阿伏加德罗常数的数值)
| A.氯气是氧化剂,FeCl3是还原剂 |
| B.常温下,与56g Fe反应断裂1.5 nA个Cl—Cl键 (相对原子质量:Fe-56) |
| C.1 L 0.1 mol?L-1 FeCl3溶液中含有0.1 nA个Fe3+ |
| D.常温常压下,22.4 L的Cl2和足量Fe反应转移3 nA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
镁铝合金6.3 g完全溶于稀硝酸,若反应中硝酸被还原只产生4.48L(标准状况下)NO气体,在反应后的溶液中,加入足量Imol.L-I的NaOH溶液,生成沉淀的质量为
| A.8.7 g | B.7.8 g | C.16.5 g | D.4.0g |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
NA表示阿伏加德罗常数的值,下列说法正确的是
①用铜作电极电解饱和NaCl溶液,当线路中通过NA个电子时,阳极产生11.2L气体(标准状况下)
②常温常压下,16gO2和16gO3含氧原子数均为NA
③标准状况下,22.4 L CH3CH2OH中含有的碳原子数为2NA
④6.5g锌全部溶于一定量的浓硫酸,生成SO2与H2的混合气体,气体分子总数为0.1 Na
⑤106gNa2CO3粉末中含有CO32-数为NA
| A.②④⑤ | B.①③⑤ | C.①②④⑤ | D.①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列化学用语正确的是 ( )
| A.1,2—二溴乙烷的结构简式:C2 H4 Br2 |
| B.羟基的化学式:OH- |
| C.己烷的分子式:C6H12 |
| D.乙烯分子的最简式:CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
用NA表示阿伏加德罗常数,下列叙述正确的是
| A.2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA |
| B.0.5molC3H8分子中所含C-H共价键数为2NA |
| C.标准状况下,22.4L乙醇完全燃烧所耗的氧气分子数为3NA |
| D.1mol碳正离子CH5+所含的电子数为11NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
标准状况下有①6.72L甲烷②3.01×1023个氯化氢分子③13.6gH2S气体④0.2mol氨
气。下列对这四种气体的关系从小到大顺序排列(用序号表示)
| A.体积______________________________ | B.密度__________________________ |
| C.质量______________________________ | D.氢原子数______________________ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
金属表面处理、皮革鞣制、印染等都可能造成铬污染。六价铬比三价铬毒性高,更易被人体吸收且在体内蓄积。
⑴工业上处理酸性含Cr2O72-废水的方法如下:
①向含Cr2O72-的酸性废水中加入FeSO4溶液,使Cr2O72-全部转化为Cr3+。写出该反应的离子方程式: 。
②调节溶液的pH,使Cr3+完全沉淀。实验室粗略测定溶液pH的方法为 ;25℃,若调节溶液的pH=8,则溶液中残余Cr3+的物质的量浓度为 mol/L。(已知25℃时,Ksp[Cr(OH)3]=6.3×10-31)
⑵铬元素总浓度的测定:准确移取25.00mL含Cr2O72-和Cr3+的酸性废水,向其中加入足量的(NH4)2S2O8溶液将Cr3+氧化成Cr2O72-,煮沸除去过量的(NH4)2S2O8;向上述溶液中加入过量的KI溶液,充分反应后,以淀粉为指示剂,向其中滴加0.015mol/L的Na2S2O3标准溶液,终点时消耗Na2S2O3溶液20.00mL。
计算废水中铬元素总浓度(单位:mg·L-1,写出计算过程)。
已知测定过程中发生的反应如下:
①2Cr3++3S2O82-+7H2O =Cr2O72-+6SO42-+14H+
②Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O
③I2+2S2O32-=2I-+S4O62-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com