
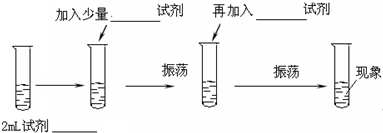
分析 根据同一氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性来设计实验,要想比较氯气的氧化性大于溴的氧化性,只要使氯气和溴的盐溶液混合观察是否有溴单质生成,如果有溴单质生成就说明氯气的氧化性大于溴单质,否则不能证明.
解答 解:(1)要想比较氯气和溴单质的氧化性大小,做如下实验:
少量溴化钠反应→加适量氯水(振荡,溶液由黄绿色变成橙色)→加入四氯化碳(振荡)→现象(溶液分层,下层橙红色,上层无色)→说明氯气和溴离子反应,能证明氯气的氧化性大于溴.
故答案为:NaBr溶液;氯水;四氯化碳;
(2)溴单质在四氯化碳中的溶解度大于在水中的溶解度,水和四氯化碳是互不相溶的,所以会看到:溶液分层,下层橙红色,上层无色;故答案为:液分层,下层橙红色,上层无色;
(3)通过以上实验知,氯气能将溴单质置换出来,氯气的氧化性大于溴,离子方程式为:Cl2+2Br-=Br2+2Cl-.
故答案为:Cl2+2Br-=Br2+2Cl-.
点评 本题考查了探究卤素单质间的置换反应,明确实验目的、正确选取实验药品、能根据实验现象得出结论是解本题的关键,对学生来说难度较大.


科目:高中化学 来源: 题型:解答题
 A、B、C、D、E五种溶液分别是NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:
A、B、C、D、E五种溶液分别是NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第二周期元素从左到右,最高正价从+1递增到+7 | |
| B. | 同主族元素的简单阴离子还原性越强,其原子的非金属性越强 | |
| C. | IA族与 VIIA族元素间可形成共价化合物或离子化合物 | |
| D. | 同周期金属元素的化合价越高,其原子失电子能力越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
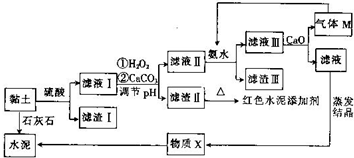 土壤是人类赖以生存的最基本物质,以黏土为原料生产的产品伴随着人类文明的脚步.皖北名胜皇藏峪的黏土,水浸不塌,是生产无机非金属材料的优质原料.某兴趣小组以当地黏土为原料探究彩色水泥、轻质耐火材料的联合生产,其设计的流程如图所示.
土壤是人类赖以生存的最基本物质,以黏土为原料生产的产品伴随着人类文明的脚步.皖北名胜皇藏峪的黏土,水浸不塌,是生产无机非金属材料的优质原料.某兴趣小组以当地黏土为原料探究彩色水泥、轻质耐火材料的联合生产,其设计的流程如图所示.| Fe(OH)2 | Fe(OH)3 | Al(OH)3 | |
| 开始沉淀时的pH | 6.3 | 1.9 | 3.4 |
| 完全沉淀时的pH | 8.3 | 3.2 | 4.7 |
 ;向滤液Ⅲ中加放CaO的作用是与水反应放热,降低NH3的溶解度(任写一条).
;向滤液Ⅲ中加放CaO的作用是与水反应放热,降低NH3的溶解度(任写一条).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com