
三氧化二铁和氧化亚铜是红色粉末,常作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fc2O3、Cu2O或二者的混合物。探究过程如下:
查阅资料知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
提出假设:假设l:红色粉末是Fc2O3 假设2:红色粉末是Cu2O
假设3:红色粉末是Fc2O3和Cu2O的混合物
设计实验:取少量粉末放人足量稀硫酸中,在所得溶液中再滴加KSCN溶液。
(1)若假设1成立,则实验现象是__ 。
(2)若滴入 KSCN溶液后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?____。筒述你的理由 .
(3)若固体粉末完全溶解无固体存在,滴加KSCN溶液时溶液不变红色,则证明原固体粉末是Fc2O3,和Cu2O的混合物,则其质量比为____,写出其中发生的氧化还原反应的离子方程式 。探究延伸:经实验分析,确定红色粉末为Fc2O3,和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数。取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg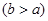 ,则混合物中Cu2O的质量分数为 。
,则混合物中Cu2O的质量分数为 。
(5)实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4·5H2O)。经查阅资料得知在溶液中通过调节溶液的酸碱性而使Cu2+、Fe3+、Fe2+分别生成沉淀的pH如下:
| 物 质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
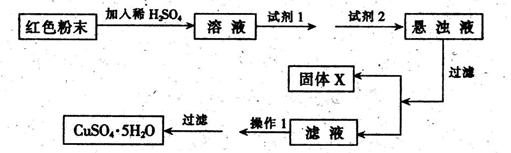
(1)固体完全溶解,溶液变为红色;(2)不合理 红色粉末若是Fe2O3和Cu2O的混合物,放入足量稀硫酸中会有Cu生成,Cu能将Fe3+还原为Fe2+,滴加KSCN试剂后溶液可能不变红色,
(3)10:9 Fe2O3+6H+=2Fe3++3H2O、Cu2O+2H+=Cu+Cu2++H2O、2Fe3++Cu=2Fe2++Cu2+
(4)[9(b?a) ]/a ×100%;(5)①B、D②Fe(OH)3?蒸发浓缩 ,冷却结晶
解析试题分析:(1)若红色粉末是Fe2O3,Fe2O3与硫酸反应生成硫酸铁,没有红色不溶物,滴加KSCN溶液,溶液变为红色;(2)红色粉末若是Fe2O3和Cu2O的混合物,放入足量稀硫酸中会有Cu生成,Cu能将Fe3+还原为Fe2+,滴加KSCN试剂后溶液可能不变红色,所以说法不合理;(3)因为Cu2O溶于硫酸生成Cu和CuSO4,而H2SO4不能溶解Cu,所以混合物中必须有Fe2O3存在,使其生成的Fe3+溶解产生的Cu,反应的有关离子方程式为Fe2O3+6H+=2Fe3++3H2O、Cu2O+2H+=Cu+Cu2++H2O、2Fe3++Cu=2Fe2++Cu2+;溶液不变红,且无固体残留,即为恰好完全反应,氧化铁和氧化亚铜的物质的量比值为1:1,质量比:10:9。
(4)Cu2O~~~2CuO 质量增重△w
144 g 16 g
m(Cu2O) (b-a) g
所以m(Cu2O)=[144g×(b?a)g ]:16g =9(b-a)g,
故混合物中Cu2O的质量分数为[9(b?a) ]/a ×100%;
(5)红色粉末为Fe2O3和Cu2O的混合物,由工艺流程可知,放入足量稀硫酸中会有Cu生成,Cu能将Fe3+还原为Fe2+,所得的溶液含有Fe2+,加入试剂1目的是Fe2+将为Fe3+,氯气会引入氯离子,故试剂1应选择B.H2O2;加入试剂2目的是调节溶液的PH值使Fe3+转化为Fe(OH)3沉淀除去,过滤得到硫酸铜溶液,氢氧化钠会引入钠离子,故试剂2应选择Cu2(OH)2CO3,得到的沉淀x为Fe(OH)3,接下来蒸发浓缩,冷却结晶。
考点:本题考查实验的设计及评价,以及物质的组成的测定,难度较大,注意把握题给信息,是对所需知识的综合考查,需要学生具有扎实的基础与综合运用分析能力.


 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:实验题
(12分)为回收和利用废旧塑料减轻“白色污染”,某兴趣小组进行如下探究:
| 实验课题 | 探究废旧塑料热分解的主要产物为多种烃的混合物 |
| 查阅资料 | ①CuO能将烃氧化成CO2和H2O; ②甲苯可被酸性KMnO4溶液氧化为苯甲酸,苯甲酸能溶于苯。 |
| 实验设计 |   |
| 实验记录 | 按上图连接装置,隔绝空气强热装置A中的试管(忽略装置内空气的影响),一段时间后,可观察到如下现象: ①B装置试管中有液态物质生成; ②C中溴水的颜色变浅; ③E中黑色氧化铜变红; ④F中无水硫酸铜变蓝。 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某废水样品中含有一定量的K+、HCO3—、SO32—,甲、乙两研究小组欲测定其中SO32—的浓度。
甲组方案: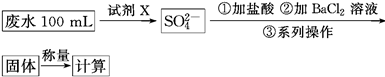
乙组方案:
①用烧杯盛取废水适量,加适量活性炭除色;过滤,取滤液。
②精确量取20.00 mL过滤后的废水试样,用0.1 mol·L-1紫色KMnO4(H2SO4酸化)溶液进行滴定(有关反应为2MnO4—+5SO32—+6H+=2Mn2++5SO42—+3H2O)。
③记录数据,计算。
(1)甲组方案中的“试剂X”可选用________。
a.0.1 mol·L-1 KMnO4(H2SO4酸化)溶液
b.0.5 mol·L-1 KOH溶液
c.新制氯水
d.NaI溶液
(2)甲组方案中,加入试剂X后生成SO42—的离子方程式为________________。
(3)甲组方案中,第③步的“系列操作”包含的操作名称依次为__________________。
(4)为乙组方案设计的下列滴定方式中,最合理的是________(填字母序号),达到滴定终点时可观察到的现象是__________________。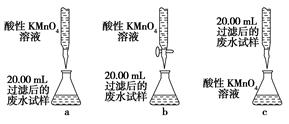
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
保护环境是全球关注的问题。
Ⅰ.某环保部门处理含CN-电镀废水的方法如图(CN-的CNO-中的N的化合价均为-3价):
某学习小组依据上述方法,用下图实验装置进行该电镀废水处理的研究。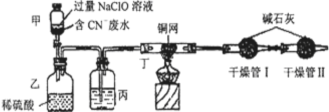
操作步骤:
i.先关闭装置甲的开关,再将含CN-废水与过量NaClO溶液混合,取200mL混合液(其中c(CN-)为0.200mol·L-1)加到装置甲中,塞上橡皮塞。
ii.装置甲中,充分反应后,打开橡皮塞和开关,使溶液全部流入装置乙中,关闭开关。
iii.测定干燥管I增加的质量。
(1)写出装置乙中反应的离子方程式: 。
(2)装置丙中的试剂是 ,装置丁的作用是 。
(3)假定上述实验中的气体都被充分吸收。若干燥管I增重1.408g。则CN-被处理的百分率为 。
(4)你认为用此装置进行实验,与(3)对比,CN-被处理的百分率将 (填“偏高”、“偏低”、“无法确定”或“无影响”)。简述你的理由: 。
Ⅱ.防治空气污染,燃煤脱硫很重要。目前,科学家对Fe3+溶液脱硫技术的研究已取得新成果。
(5)科学研究表明,脱硫率与Fe3+浓度、pH关系如图1、2。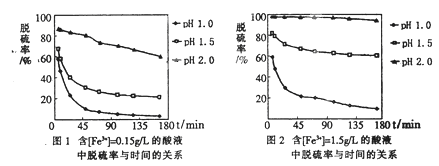
为达到最佳脱硫效果,应采取的适合[Fe3+]及pH分别是 、 。
(6)某学习小组为了探究“SO2与Fe3+反应的产物”,将过量的SO2通入FeCl3溶液后,各取10mL反应液分别加到编号为A、B、C的试管中,并设计后续实验的3个方案:
方案①:A中加入少量KMnO4溶液,紫红色褪去。
方案②:B中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:C中加入稀盐酸酸化的BaCl2溶液,产生白色沉淀。
上述实验方案中不合理的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某研究性学习小组将一定浓度的Na2CO3溶液滴入CuSO4。溶液中得到蓝色沉淀。关于沉淀的成分,有以下几种假设:
假设1:沉淀是CuCO3;
假设2:沉淀是Cu(OH)2;
假设3:沉淀是_____________________________________。
(1)若假设1成立,则发生反应的离子方程式为_______________________________。
(2)若假设2成立,原因是__________________________________________________。
(3)该研究性学习小组拟用以下装置测定沉淀成分,请完成下表。已知:①CuCO3和Cu(OH)2均不带结晶水;②装置气密性良好;③原装置中的空气对实验结果的影响可忽略。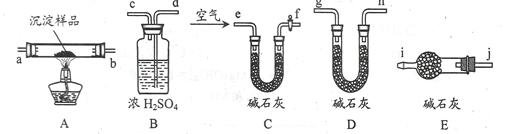
| 实验步骤 | 预期现象 | 结论 |
| ①称量B、D的质量分别为ml、m2,将装置按 f→a→b→___→___→___→___→j→i顺序连接。 | | |
| ②称取一定质量的沉淀______________________,然后___________________,冷却后再称量B、D的质量分别为m3、 m4 | (1)若m1 = m3,m2 < m4 (2)若m1___m3,m2___m4 (3)若ml___m3,m2___m4 | (1)假设1成立 (2)假设2成立 (3)假设3成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某校化学兴趣小组设计了如下实验装置(图中部分夹持仪器已略去)来测定某铁碳合金中铁的质量分数,并探究铁与浓硫酸的反应。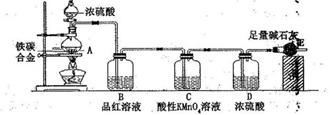
请回答下列问题:
(1)mg铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A、B均无明显现彖,其原因是①_____②_____
(2)点燃酒精灯,可观察到B中的现象是_____________________,C 的作用是___________________
(3)待A中不再逸出气体时,停止加热,拆下E并称重,E增重bg。则铁碳合金中铁的质量分数为________________(写表达式)。
(4)兴趣小组使用设计的如图实验装置,操作正确,且每一个反应均完全,仍然发现所测得的铁碳合金中铁的质量分数偏低,其主要原因是________________。
(5)若反应一段时间后,用滴管吸取A中的溶液滴入到适量水中作为试样,试样中所含金属离子的成分有以下三种可能:
I:只含有Fe3+; II:只含有Fe2+;III:________________________
验证III的实验方法是________________________
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
乙醛能与银氨溶液反应析出银。如果条件控制适当,析出的银会均匀地分布在试管壁上,形成光亮的银镜,这个反应又叫银镜反应。银镜的光亮程度与反应条件有关。某课外活动小组同学在课外活动中对乙醛的银镜反应进行了探究。
Ⅰ. 探究银镜反应的最佳实验条件部分实验数据如下表:
| 实验变量 实验序号 | 银氨溶液 /mL | 乙醛的量 /滴 | 水液温度/℃ | 反应混合液的PH | 出现银镜时间/min |
| 1 | 1 | 3 | 65 | 11 | 5 |
| 2 | 1 | 3 | 45 | 11 | 6.5 |
| 3 | 1 | 5 | 65 | 11 | 4 |
| 4 | 1 | 3 | 30 | 11 | 9 |
| 5 | 1 | 3 | 50 | 11 | 6 |
| 6 | 1 | 5 | 80 | 11 | 3 |
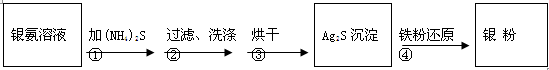
 2 Ag+ FeCl2+H2S↑。
2 Ag+ FeCl2+H2S↑。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(17分)美日科学家因研发“有机合成中的钯催化的交叉偶联”而获得2010年度诺贝尔化学奖。有机合成常用的钯/活性炭催化剂长期使用,催化剂会被杂质(如:铁、有机物等)污染而失去活性,成为废催化剂,故需对其回收再利用。一种由废催化剂制取氯化钯(PdCl2)的工艺流程如下: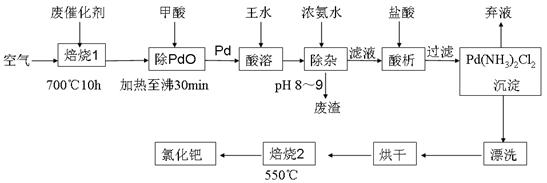
(1)甲酸还原氧化钯的化学方程式为 。
(2)加浓氨水时,钯元素转变为可溶性[Pd(NH3)4]2+,此时铁元素的存在形式是 (写化学式)。
(3)王水是浓硝酸与浓盐酸按体积比1∶3混合而成的,钯在王水中溶解的过程中有化合物A和一种无色、有毒气体B生成。
①气体B的化学式为
②经测定,化合物A由3种元素组成,有关元素的质量分数为Pd:42.4%,H:0.8%。则A的化学式为 ;
(4)钯的回收率高低主要取决于王水溶解的操作条件,已知反应温度、反应时间和王水用量对钯回收率的影响如图1~图3所示,则王水溶解钯的适宜条件是:反应温度为 ,反应时间约为 ,含钯的样品与王水的质量比为 。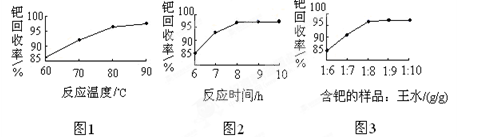
(5)700℃“焙烧1”的目的是 , 550℃“焙烧2”的目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列与化学有关的说法正确的是
| A.富含氮、磷的生活污水不能排放到河中,但可以直接用于农田的灌溉 |
| B.高温加热氧化镁和碳的混合物可以制得单质镁 |
| C.白酒标签上注有“酒精浓度53%VO1”字样,它表示100g该白酒中含有53g酒精 |
| D.瓷坩埚能耐高温,可以用于加热分解石灰石 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com