
| A. | Ba(OH)2溶液中加入过量Al2(SO4)3溶液:3Ba2++6OH-+2Al3++3SO42-═3 BaSO4↓+2Al(OH)3↓ | |
| B. | 将少量CO2通入NaClO溶液中:ClO-+CO2+H2O═HCO3-+HClO (已知:次氯酸的Ka为2.95×10-8,碳酸的Ka2为5.6×10-11) | |
| C. | 次氯酸钙溶液中通入足量SO2:Ca2++ClO-+SO2+H2O═CaSO4↓+Cl-+2H+ | |
| D. | 向Ca(OH)2溶液中加入过量的NaHCO3溶液:Ca2++2HCO3-+2OH-═CO32-+CaCO3↓+2H2O |
分析 A.Al2(SO4)3溶液中加入少量Ba(OH)2溶液,既有硫酸钡沉淀,又有氢氧化铝沉淀;
B.电离常数越大物质酸性越强,已知电离平衡常数:H2CO3>HClO>HCO3-,则酸性强弱顺序为:H2CO3>HClO>HCO3-,结合反应中强酸制备弱酸的规律解答;
C.钙离子与次氯酸根离子不符合配比
D.澄清的石灰水中加人过量的NaHCO3溶液,少量的石灰水要符合组成之比;
解答 解:A.Ba(OH)2溶液中加入过量Al2(SO4)3溶液的离子反应为:2Al3++6OH-+3Ba2++3SO42-=3BaSO4↓+2Al(OH)3↓,故A正确;
B.H2CO3>HClO>HCO3-,则NaClO溶液中通入少量二氧化碳反应生成次氯酸和碳酸氢钠,离子方程式为:ClO-+CO2+H2O═HCO3-+HClO,故B正确;
C.次氯酸钙溶液中通入足量SO2,反应的离子方程式为:2ClO-+Ca2++2H2O+2SO2=2Cl-+CaSO4↓+4H++SO4 2-,故C错误;
D.澄清的石灰水中加人过量的NaHCO3溶液,少量的石灰水要符合组成之比,正确的离子方程式为Ca2++2OH?+2HCO3?═CaCO3↓+2H2O+CO32?,故D正确;
故选C.
点评 本题考查了离子方程式的书写正误判断,依据电离常数判断酸性强弱,明确强酸制备弱酸规律、量不同产物不同,量少的全部反应、氧化还原反应实质理解等是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
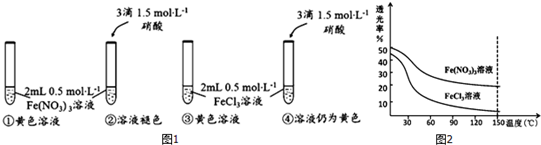
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
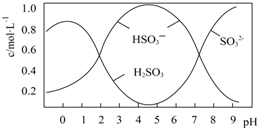 葡萄酒常用Na2S2O5做抗氧化剂,25℃时,将0.5molNa2S2O5溶于水配成1L溶液,该溶液pH=4.5,溶液中部分微粒不正确的是( )
葡萄酒常用Na2S2O5做抗氧化剂,25℃时,将0.5molNa2S2O5溶于水配成1L溶液,该溶液pH=4.5,溶液中部分微粒不正确的是( )| A. | Na2S2O5溶于水的化学方程式:Na2S2O5+H2O=2NaHSO3 | |
| B. | 由图形可知,25℃时,HSO3-的水解平衡常数约为10-12 | |
| C. | 当溶液pH小于0.5后,图中曲线变化的原因可能是H2SO3被部分氧化 | |
| D. | 向溶液中加入碱性物质使溶液pH升高的过程中,一定存在如下关系:c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子的种类由原子核内质子数、中子数决定 | |
| B. | 元素的种类由原子核内质子数、中子数决定 | |
| C. | 32He代表原子核内有2个质子和3个中子的氦原子 | |
| D. | 178O和188O原子的核外电子数是前者大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
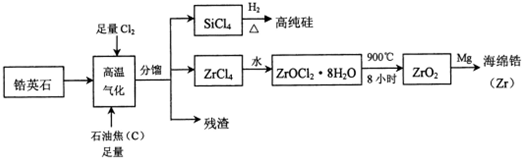
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C5H12有三种不同的结构,其中一种同分异构体的名称是2,2-二甲基丙烷 | |
| B. | 聚乙烯(PE)和聚氯乙烯(PVC)的单体都是不饱和烃,均能使溴水褪色 | |
| C. | 用新制的Cu(OH)2悬浊液可以鉴别乙酸、乙醇和葡萄糖 | |
| D. | 不同条件下,乙稀可与氧气反应生成乙醛、乙酸、环氧乙烷(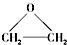 ),这些反应都属于氧化反应 ),这些反应都属于氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com