
已知反应X+Y═M+N为放热反应,对该反应的说法正确是
A.X的能量一定高于M
B.Y的能量一定高于N
C.X和Y的总能量一定高于M和N的总能量
D.因为该反应为放热反应,故不必加热就可发生
科目:高中化学 来源:2015-2016学年吉林省高二9月检测化学试卷(解析版) 题型:选择题
下列说法正确的是
A.石油的分馏和煤的干馏都是物理变化
B.甲烷、苯、乙酸乙酯都可以发生取代反应
C.油脂、蛋白质和纤维素都是高分子化合物
D.在加热、甲醛、饱和(NH4)2SO4溶液、X射线作用下,蛋白质都会发生变性
查看答案和解析>>
科目:高中化学 来源:2016届贵州省遵义市高三上学期第一次月考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列叙述正确的是
A.8g18O2含有的中子数为5N A
B.1molFeI2与足量Cl2氯气充分反应转移的电子数为2NA
C.标准状况下22.4LNO与11.2LO2混合后的气体分子数约为NA
D.7.8 g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁葫芦岛一中高二上期初考试化学试卷 (解析版) 题型:选择题
根据碘与氢气反应的热化学方程式,下列判断正确的是
① I2(g)+ H2(g)  2HI(g) △H=-9.48 kJ/mol
2HI(g) △H=-9.48 kJ/mol
② I2(s)+ H2(g)  2HI(g) △H=+26.48 kJ/mol
2HI(g) △H=+26.48 kJ/mol
A.254g I2(g)中通入2g H2(g),反应放热9.48 kJ
B.当反应②吸收52.96kJ热量时转移2mole一
C.反应②的反应物总能量比反应①的反应物总能量低
D.1 mol固态碘与1 mol气态碘所含能量相差17.00 kJ
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江大庆铁人中学高二上9月考化学试卷(解析版) 题型:选择题
下图两个装置中,液体体积均为200ml,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上都通过了0.02mole—,若不考虑溶液体积的变化,下列叙述正确的是

A.产生气体体积①=②
B.电极上析出固体质量①<②
C.电极反应式:①中阳极:4OH-—4e-=2H2O+O2↑②中负极2H++2e-=H2↑
D.溶液的pH变化:①减小②增大
查看答案和解析>>
科目:高中化学 来源:2016届四川省高三9月月考化学试卷(解析版) 题型:填空题
(14分)光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
(1)实验室中常用来制备氯气的化学方程式为: ;
(2)实验室中可用氯仿(CHCl3)与双氧水直接反应制备光气,其反应的化学方程式为__ ;
(3)COCl2的分解反应为COCl2(g)= Cl2(g)+ CO(g) △H = +108 kJ/mol。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线未示出):
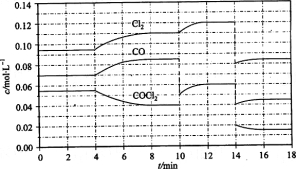
①计算反应在第8 min时的平衡常数K = __________(保留小数点后三位)
②比较第2 min反应温度T(2)与第8 min反应温度(T8)的高低:T(2)____T(8)(填“<”、“>”或“=”);
③若12 min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)= ______mol/L;
④比较产物CO在2~3 min、5~6 min和12~13 min时平均反应速率[平均反应速率分别以v (2—3)、v(5—6)、v (l2-13)表示]的大小___________;
⑤比较反应物COCl2在5-6 min和15-16 min时平均反应速率的大小:v (5-6) v(15-16)(填“<”、“>”或“=”),原因是____________。
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上期中测试化学试卷(解析版) 题型:填空题
【化学—选修2:化学与技术】(10分)生态工业园区的建设,不仅仅是体现环保理念更要依据循环经济理论和充分考虑经济的可持续发展。下面是某企业设计的硫酸-磷铵-水泥联产,海水-淡水多用,盐-热-电联产三大生态产业链流程图。
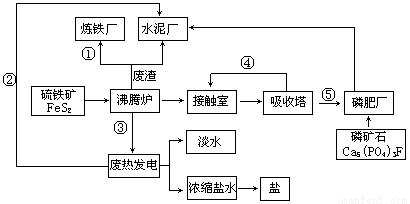
根据上述产业流程回答下列问题:
(1)从原料、能源、交通角度考虑该企业应建在
A.西部山区 B.沿海地区 C.发达城市 D.东北内陆
(2)该流程①、②、③、④、⑤为能量或物质的输送,请分别写出输送的主要物质的化学式或能量形式① ,② ,③ ,④ ,⑤ 。
(3)沸腾炉发生反应的化学方程式 ,磷肥厂的产品是普钙,其主要成份是 (填化学式)。
(4)热电厂的冷却水是 ,该流程中浓缩盐水除提取盐以外还可提取的物质有 (写出一种即可)。
(5)根据生态园区建设理念请提出高炉炼铁厂废气、废渣及多余热能的利用设想 , (请写出两点)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁育才学校高一上第一次阶段测化学试卷(解析版) 题型:填空题
(7分)实验室用密度为1.18g/mL,质量分数为36.5%浓盐酸配制250mL0.1mol/L的盐酸溶液,填空并请回答下列问题:
(1)配制250mL0.1mol/L的盐酸溶液
应量取盐酸体积/mL | 应选用容量瓶的规格/mL |
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) 。
A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2—3cm处
(3)溶液注入容量瓶前需恢复到室温,这是因为______________________。
(4)若注入容量瓶前未恢复到室温,对所配溶液浓度将有何影响? _______________(填“偏低”“偏高”“无影响”)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高一上期中测试化学试卷(解析版) 题型:填空题
(10分)实验室配制460mL0.100mol/LNa2CO3溶液回答下列问题,现有下列仪器
A.烧杯 B.100mL量筒 C.500mL容量瓶 D.药匙 E.玻璃棒 F.天平
(1)配制时,必须使用的仪器有___________________(填代号),还缺少的仪器是________________该试验中两次用到玻璃棒,其作用分别是________________,___________________
(2)应用托盘天平称取十水碳酸钠晶体的质量为___________________,若加蒸馏水不慎超过刻度线,处理的方法是______________________
(3)若实验遇下列情况,溶液的浓度是偏高、偏低还是不变.
A.溶解后没有冷却便进行定容__________________;
B.摇匀后发现液面低于标线,滴加蒸馏水至标线再摇匀___________________;
C.定容时俯视容量瓶的标线___________________;
D.容量瓶内壁附有水珠而未干燥处理___________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com