
用铝箔包住0.1 mol金属钠,用针扎一些小孔,放入水中,完全反应后,用排水集气法收集产生的气体,则收集到的气体体积(标准状况)为( )。
A.2.24 L B.1.12 L C.大于1.12 L D.小于1.12 L
科目:高中化学 来源: 题型:
硫酸铵在强热条件下分解:4(NH4)2SO4 = 6 NH3↑+ N2↑+3SO2↑+SO3↑+7H2O若将生成的气体通入氯化钡溶液中,得到的沉淀物是( )
A.BaSO3和BaSO4 B.BaS C.BaSO3 D.BaSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
在三个密闭容器中分别充入HCl、H2S、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(P)从大到小的顺序是( )
A.P(HCl) >P(H2S)>P(O2) B.P(O2)> P(H2S) > P(HCl)
C.P(H2S)>P(HCl)>P(O2) D.P(H2S)>P(O2)>P(HCl)
查看答案和解析>>
科目:高中化学 来源: 题型:
现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示:
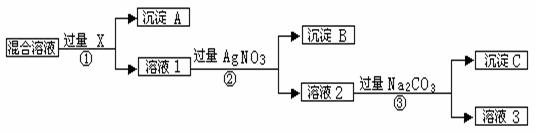
请回答下列问题:
⑴写出实验流程中下列物质的化学式: 试剂X : ,沉淀A: ,沉淀B: 。
⑵上述实验流程中加入过量的Na2CO3的目的是 。
⑶按此实验方案得到的溶液3中肯定含有 (填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的 ,之后若要获得固体NaNO3需进行的实验操作是 _________(填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
钾(K)与钠(Na)在性质上具有很大的相似性,但K比Na的活泼性强,下面是根据Na的性质对K的性质的预测,其中正确的是( )。
A.K的活泼性强,所以钾应该保存在煤油中
B.K可被空气中的氧气氧化,且氧化产物在常温和加热条件下均为K2O
C.K与水能够反应,但不如Na与水的反应剧烈,但产物都有氢气
D.K可以与水剧烈反应,生成氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
在标准状况下进行甲、乙、丙三组实验。三组实验各取同浓度的盐酸30 mL,加入同一种镁铝合金粉末,产生气体,有关数据列表如下(气体体积在标准状况下测定):
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 255 | 385 | 459 |
| 气体体积/mL | 280 | 336 | 336 |
(1)乙组实验中,盐酸________(填“过量”“适量”或“不足量”),理由是________________。
(2)要计算盐酸的物质的量浓度,题中可作计算依据的数据是________。
(3)要计算合金中Mg、Al的物质的量之比,题中可作计算依据的数据是________,Mg、Al的物质的量之比是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可表示为:
2KClO3+4HCl (浓)==2KCl+2ClO2↑+Cl2↑+2H2O。
(1)请分析该反应中电子转移的情况(用双线桥法表示)。
(2)浓盐酸在反应中显示出来的性质是________(填序号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)若产生0.1 mol Cl2,则转移的电子的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关热化学方程式的叙述正确的是
A.2H2(g)+O2(g)===2H2O(g);△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ
B.已知C(石墨,s)=== C(金刚石,s) △H>0,则金刚石比石墨稳定
C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应的热化学方程式为:NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l);△H=-57.4 kJ/mol
D.已知2C(s)+2O2(g)==2CO2(g);△H1 ;2C(s)+O2(g)=2CO(g) △H2。则△H1>△H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com