
【题目】下面鉴别葡萄糖与果糖的方法正确的是( )
A.银镜反应B.新制的氢氧化铜
C.氢氧化钙溶液D.羧酸溶液
 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】己知:CH4(g)+2H2S(g)![]() CS2(g)+4H2(g)。向恒容密闭容器中充入0.lmolCH4 和0.2molH2S,下图所示:
CS2(g)+4H2(g)。向恒容密闭容器中充入0.lmolCH4 和0.2molH2S,下图所示:

下列说法正确的是
A. 该反应的△H<O
B. X 点CH4的转化率为20%
C. X点与Y点容器内压强比为55:51
D. 维持Z点温度,向容器中再充入CH4、H2S、CS2、H2 各0.1mol 时V(正)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式及其叙述正确的是( )
A. 氢气的燃烧热为285.5 kJ·mol-1,则水分解的热化学方程式为:2H2O(l)===2H2(g)+O2(g) ΔH=+285.5 kJ·mol-1
B. 已知2C(石墨,s)+O2(g)===2CO(g)ΔH=-221 kJ·mol-1,则石墨的燃烧热为110.5 kJ·mol-1
C. 已知N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1,则在一定条件下将1 mol N2和3 mol H2置于一密闭容器中充分反应后,最多可放出92.4 kJ的热量
2NH3(g) ΔH=-92.4 kJ·mol-1,则在一定条件下将1 mol N2和3 mol H2置于一密闭容器中充分反应后,最多可放出92.4 kJ的热量
D. 氢气的燃烧热为285.5 kJ·mol-1,则氢气的燃烧热的热化学方程式:H2(g)+1/2O2(g) ===H2O(l) ΔH=-285.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质转化在给定条件下不能实现的是
A. Fe2O3![]() FeCl3(aq)
FeCl3(aq) ![]() 无水FeCl3
无水FeCl3
B. Al2O3 ![]() NaAlO2(aq)
NaAlO2(aq) ![]() AlCl3(aq)
AlCl3(aq)
C. NH3![]() NO
NO![]() HNO3
HNO3
D. SiO2![]() H2SiO3
H2SiO3![]() Na2SiO3
Na2SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种黄绿色的气体,易溶于水,是目前国际上公认的第四代高效、无毒的消毒剂。
(1)目前,氯化钠电解法是一种可靠的工业生产ClO2的方法(如图所示)。

用石墨做电极,在一定条件下电解饱和食盐水制取ClO2,写出阳极产生ClO2的电极反应式___________________。
(2)将ClO2用水吸收得到溶液,为了测定该溶液的浓度,进行了下列实验:
步骤1:准确量取ClO2溶液10.00mL,稀释成100.0mL试样,取其中10.00mL试样加入到锥形瓶中;
步骤2:用稀硫酸调节试样的pH≤20,加入足量的KI晶体,充分反应;
步骤3:加入淀粉溶液作指示剂,用0.2mol·L-1Na2S2O3标准溶液滴定至终点,再重复2次,测得消耗Na2S2O3溶液的平均值为20.00mL。(已知:2Na2S2O3+I2=Na2S4O6+2NaI)
①若步骤2所得溶液放置时间太长,则测定结果会__________。(填“偏高”、“偏低”或“不变”)
②步骤3中,滴定终点的现象是__________________ 。
③通过计算确定原ClO2溶液的物质的量浓度。(写出计算过程)_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性溶液中分解产生S、SO2。
Ⅰ.Na2S2O3的制备。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3 +CO2制得,实验室模拟该工业过程的装置如图所示。
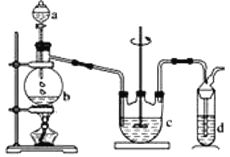
(1)b中反应的离子方程式为____,c中试剂为_____。
(2)反应开始后,c中先有浑浊产生,后又变澄清。此浑浊物是_____。
(3)实验中要控制SO2生成速率,可以采取的措施有______(写出两条)。
(4)为了保证硫代硫酸钠的产量,实验中通入的SO2,不能过量,原因是____。
(5)制备得到的Na2S2O3中可能含有Na2SO3、Na2SO4等杂质。设计实验,检测产品中是否存在Na2SO4:_____。
Ⅱ.探究Na2S2O3与金属阳离子的氧化还原反应。
资料:ⅰ.Fe3++3S2O32-![]() Fe(S2O3)33-(紫黑色)
Fe(S2O3)33-(紫黑色)
ⅱ.Ag2S2O3为白色沉淀,Ag2S2O3可溶于过量的S2O32-
装置 | 编号 | 试剂X | 实验现象 |
| ① | Fe(NO3)3溶液 | 混合后溶液先变成紫黑色, 30s后溶液几乎变为无色 |
② | AgNO3溶液 | 先生成白色絮状沉淀,振荡后,沉淀溶解,得到无色溶液 |
(6)根据实验①的现象,初步判断最终Fe3+被S2O32-还原为Fe2+。从化学反应速率和平衡的角度解释实验Ⅰ的现象:_____。
(7)同浓度氧化性:Ag+ > Fe3+。实验②中Ag+未发生氧化还原反应的原因是____。
(8)进一步探究Ag+和S2O32-反应。
装置 | 编号 | 试剂X | 实验现象 |
| ③ | AgNO3溶液 | 先生成白色絮状沉淀,沉淀很快变为黄色、棕色,最后为黑色沉淀。 |
实验③中白色絮状沉淀最后变为黑色沉淀(Ag2S)的化学方程式如下,填入合适的物质和系数:Ag2S2O3+___=Ag2S+___
(9)根据以上实验,Na2S2O3与金属阳离子发生氧化还原反应和___有关(写出两条)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com