
| A. | 生活中,用饱和碳酸钠溶液洗去锅碗瓢盆上的油污,且热溶液的效果更好 | |
| B. | 常温下,铁、铝在浓硝酸中钝化 | |
| C. | 侯氏制碱工业中,降温析出副产品NH4Cl之前,向溶液中既撒NaCl固体又通入足量NH3 | |
| D. | 夏天,打开冰镇汽水瓶,立即冒出大量泡沫 |
分析 勒夏特利原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动,勒夏特利原理适用的对象应存在可逆过程,如与可逆过程的平衡移动无关,则不能用勒夏特利原理解释.
解答 解:A.饱和碳酸钠溶液洗去锅碗瓢盆上的油污,实际上是用碳酸根水解出的氢氧根去油污,因为碱能使酯类水解,碳酸根的水解是吸热过程,加热能促进水解,故热溶液的效果更好,所以可以用平衡移动原理解释,故A不选;
B.常温下,Fe、Al和浓硝酸发生氧化还原反应生成一层致密的氧化物薄膜而阻止进一步被氧化,该现象为钝化现象,不存在可逆反应,不能用平衡移动原理解释,故B选;
C.氯化钠溶解度随温度变化不明显,氯化铵溶解度随温度变化较大,加入氨气促进生成氯化铵,存在可逆反应,可以用勒夏特里原理解释,故C不选;
D.溶液中存在二氧化碳的溶解平衡CO2+H2O?H2CO3,打开汽水瓶时,瓶内的压强减小平衡逆向移动,因此瓶内的二氧化碳会从瓶中溢出,能用平衡移动原理解释,故D不选;
故选B.
点评 本题考查勒夏特里原理,为高频考点,明确勒夏特里原理的适用范围是解本题关键,只有改变条件时能引起平衡移动的才能用平衡移动原理解释,否则不能用平衡移动原理解释,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 40 mL | B. | 72 mL | C. | 128 mL | D. | 20 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol/L的CaCl2溶液中含Cl-的数目为2NA | |
| B. | 标准状况下,22.4LCl2和H2混合气体原子数为2NA | |
| C. | 0.1mol AlCl3完全转化为氢氧化铝胶体,会生成0.1NA个胶粒 | |
| D. | 常温常压下,100g 40%NaOH水溶液含氧原子总数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=4的醋酸中:c(H+)=4.0mol•L-1 | |
| B. | 饱和小苏打溶液中:c(Na+)>c(HCO3-) | |
| C. | 饱和食盐水中:c(Na+)+c(H+)=c(Cl-) | |
| D. | pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
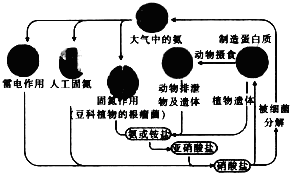
| A. | 含氮无机物和含氮有机物可相互转化 | |
| B. | 通过闪电产生NO属于高能固氮 | |
| C. | 硝酸盐被细菌分解为氮气过程氮元素一定被氧化 | |
| D. | C、H、O也参与自然界中氮循环 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油中含有C5~C11的烷烃,可以通过石油的分馏得到汽油 | |
| B. | 含C18以上烷烃的重油经过催化裂化得到汽油 | |
| C. | 石油的裂解是化学变化,石油的分馏是物理变化 | |
| D. | 石油裂解气的主要成分是各种烯烃,并不含有烷烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LCC14含有的分子数为NA | |
| B. | 常温常压下,17gNH3所含的原子数目为4NA | |
| C. | 1molNa2O2与H20完全反应,转移2NA个电子 | |
| D. | O.lmol/LNa2CO3溶液中含有的Na+数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
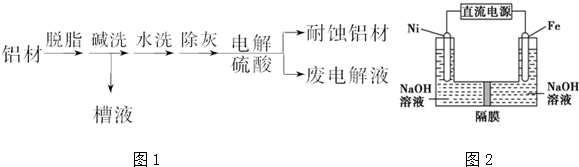
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com