
| 催化剂 |
| 高温高压 |
| 134.4L |
| 716.8L |


科目:高中化学 来源: 题型:
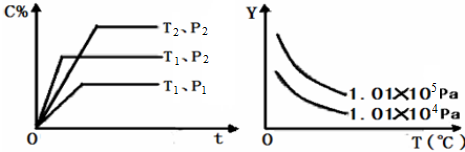
| A、平衡混合气中物质A的百分含量 |
| B、平衡混合气中物质B的百分含量 |
| C、平衡混合气的平均摩尔质量 |
| D、平衡混合气的密度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子中C、H、O个数之比为1:2:3 |
| B、分子中C、H个数之比为1:4 |
| C、分子中不可能含有氧原子 |
| D、此有机物的最简式为CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
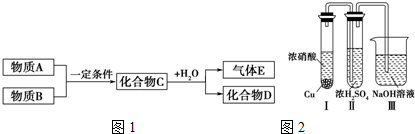
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol?L-1醋酸溶液中离子总数为0.2NA |
| B、T℃时,pH=6的纯水中,含10-8NA个OH- |
| C、25℃时,1L pH=13的氢氧化钠溶液中含有0.1NA氢氧根离子 |
| D、1L 0.1 mol?L-1的硫化钠溶液中硫离子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、33% | B、40% |
| C、50% | D、67% |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
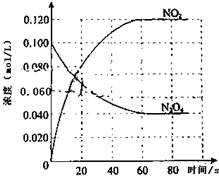 在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.回答下列问题:
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | K+ Cu2+ Fe3+ Al3+ Fe2+ |
| 阴离子 | Cl- CO32- NO3- SO42- SiO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com