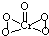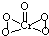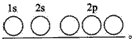【答案】
分析:(1)Fe的原子序数为26,根据能量最低原理可写出基态原子的电子排布式,进而写出Fe
2+的基态离子的电子排布式,根据能连最低原理和洪特规则和泡利不相容原理书写轨道式;
(2)根据化学式判断配位数,CrO
5中存在过氧键、Cr-O键、Cr=O,在4个Cr-O键中Cr为+1价,在Cr=O键注重Cr为+2价,以此书写结构式;
(3)根据价层电子对数和δ键数判断分子的立体构型,O原子电负性较大,氢化物中含有氢键;
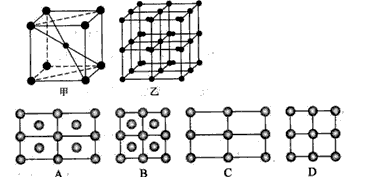
(4)根据晶胞堆积形成较大晶体,按甲虚线方向切乙形成的纵截面分析;
(5)利用均摊法计算.
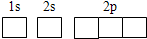
解答:解:(1)Fe的原子序数为26,Fe的基态原子的电子排布式为1s
22s
22p
43s
23p
43d
64s
2,则Fe
2+的基态离子的电子排布式为[Ar]3d
6或1s
22s
22p
43s
23p
43d
6,C原子序数为6,则基态碳(C)原子的轨道表示式为

,
故答案为:[Ar]3d
6或1s
22s
22p
43s
23p
43d
6;

;
(2)[Cr(H
2O)
4Cl
2]Cl?2H
2O中Cr与4个H
2O,2个Cl
-形成配位键,所以配位数为6,CrO
5中存在过氧键、Cr-O键、Cr=O,在4个Cr-O键中Cr为+1价,在Cr=O键中Cr为+2价,则结构式为
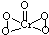
,
故答案为:6;
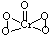
;
(3)H
2O中含有2个δ键,2个孤电子对,则分子的立体构型为C形,O原子电负性较大,氢化物中含有氢键,
故答案为:V形分子;分子中有带孤电子对、电负性较强的氧原子,而且有一个与电负性较强的氧原子直接相连的氢原子;
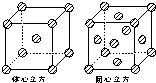
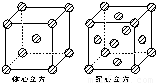
(4)甲中Fe位于顶点和体心,乙由8各甲组成,按甲虚线方向切乙形成的纵截面边长不相等,则排除B、D,由于每个小晶胞中的体心含有1个Fe原子,则应为A,故答案为:A;
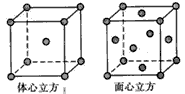
(5)图4中体心立方晶胞Fe原子位于顶点和体心,晶胞中含有1+8×

=2个Fe原子,
面心立方晶胞中Fe原子位于顶点和面心,晶胞中含有6×

+8×

=4个Fe原子,
所以两种晶体的基本结构单元中的原子个数之比为2:4=1:2,
故答案为:1:2.
点评:本题考查较为综合,涉及电子排布式、结构式以及晶胞的计算,本题易错点为(4),注意把握题目信息.

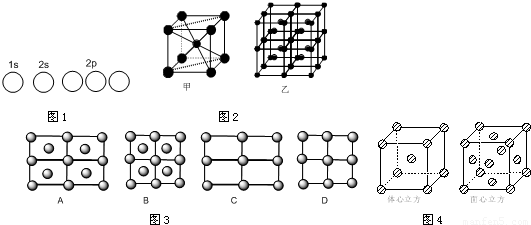
 ,
, ;
;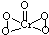 ,
,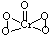 ;
; =2个Fe原子,
=2个Fe原子, +8×
+8× =4个Fe原子,
=4个Fe原子,

 阅读快车系列答案
阅读快车系列答案