(2013?重庆二模)铬是一种银白色的坚硬金属,铬的工业用途很广,主要有金属加工、电镀、制革行业,这些行业排放的废水和废气是环境中的主要污染源.请回答下面与铬有关的一些问题.

(1)工业上冶炼铬的主要步骤如图1所示:
①已知步骤Ⅱ的反应方程式为:8Na
2CrO
4+6Na
2S+23H
2O═8Cr(OH)
3↓+3Na
2S
2O
3+22NaOH.该反应中氧化剂是
Na2CrO4
Na2CrO4
(填化学式),生成1mol Cr(OH)
3时转移电子的物质的量为
3
3
mol;
②步骤IV中电解Cr
2O
3的阳极反应式为
2O2--4e-=O2↑
2O2--4e-=O2↑
(2)某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,原理示意图如图2,A为电源的
正极
正极
(填“正极”“负极”),阳极区溶液中发生的氧化还原反应为
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
(3)化学需氧量(COD)可量度水体受有机物污染的程度.它是在强酸并加热条件下,用K
2Cr
2O
7作强氧化剂处理水样时所消耗的K
2Cr
2O
7的量,换算成相当于O
2的含量(以mg/L计).某研究性学习小组测定某水样的化学需氧量(COD),过程如下:
Ⅰ.取Va mL水样于锥形瓶,加入l0.00mL 0.2500mol/L K
2Cr
2O
7溶液;
Ⅱ.加碎瓷片少许,然后慢慢加入少量硫酸,混合均匀,加热;
Ⅲ.反应完毕后,冷却,加指示剂,用c mol/L的硫酸亚铁铵(NH
4)
2Fe(SO
4)
2溶液滴定.终点时消耗硫酸亚铁铵溶液Vb mL(此步操作的目的是用Fe
2+把多余的Cr
2O
72-反应成Cr
3+)
①Ⅰ中,量取K
2Cr
2O
7溶液的仪器是
酸式滴定管(或移液管)
酸式滴定管(或移液管)
②Ⅱ中,碎瓷片的作用是
防止暴沸
防止暴沸
③该水样的化学需氧量COD=
(用含c、Va、Vb的表达式表示).



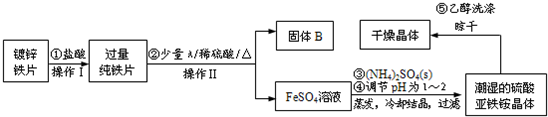
 (2011?天河区一模)某铁矿石样品除含SiO2外,还含有FeO、Fe2O3中的一种或两种,某同学对铁的氧化物的成分进行探究.
(2011?天河区一模)某铁矿石样品除含SiO2外,还含有FeO、Fe2O3中的一种或两种,某同学对铁的氧化物的成分进行探究.