

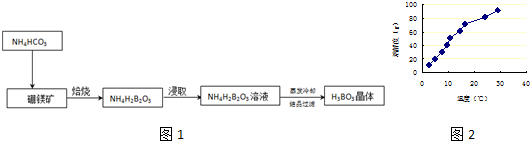
分析 (1)气球中的空气成分主要是氧气、氮气、二氧化碳、水蒸气等,通过氢氧化钠溶液除去二氧化碳,通过浓硫酸除去水蒸气;C装置是反应掉空气中的氧气;D装置是验证铜和浓硝酸反应中可能产生一氧化氮气体,必须保证不能含有氧气,才能在后续试验中通过测定气体体积判断一氧化氮气体的存在,所以D中充满氮气体积为50ml;按照气体流向进行开关的操作;
(2)A装置中二氧化碳与氢氧化钠溶液反应生成碳酸钠和水,据此写出离子方程式;C装置中铜与氧气反应生成氧化铜;
(3)根据酸碱中和反应的定量关系计算硝酸的浓度;
(4)若装置E在实验过程中出现倒吸现象,则需要降低球形管中气体的压强或与D装置隔开;
(5)根据E中生成的硝酸溶液体积为100ml,结合化学方程式计算生成的一氧化氮气体,一氧化氮和氮气的体积之和与收集的气体体积比较判断即可;
解答 解:(1)气球中的空气成分主要是氧气、氮气、二氧化碳、水蒸气等,通过氢氧化钠溶液除去二氧化碳,通过浓硫酸除去水蒸气;C装置是反应掉空气中的氧气,所以进入D装置的气体主要是氮气,试管体积为50ml,进入的氮气体积为50ml,通入氮气目的是把试管中的空气排净,避免生成的一氧化氮气体被氧气氧化为二氧化氮,无法验证铜和浓硝酸反应产物中有一氧化氮气体生成;
依据气体流向,开关操作是关闭K3,打开K1、K2,让氮气把试管中的空气赶净,更好的利用后续试验测定气体体积和验证一氧化氮气体的生成;
故答案为:N2;关闭k3,打开k1和k2;
(2)二氧化碳与氢氧化钠溶液反应生成碳酸钠和水,离子方程式为:CO2+2OH-=CO32-+H2O;铜与氧气反应生成氧化铜,方程式为:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO;
故答案为:CO2+2OH-=CO32-+H2O;2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO;
(3)从E装置所得溶液中取出25.0mL,向其中逐滴加入0.10mol/L NaOH溶液.当滴至20.0mL时两者恰好完全反应,发生的反应实质是H++OH-=H2O,可以利用酸碱恰好反应的定量关系计算即可,设硝酸浓度为C,则25.00mL×C=20.00mL×0.10mol/L,C=0.08mol/L,故答案为:0.08mol/L;
(4)若装置E在实验过程中出现倒吸现象,则需要降低球形管中气体的压强,可以向下调节量气管或与D装置隔开,需及时关闭k3;
故答案为:向下调节量气管(或及时关闭k3);
(5)通过计算分析判断,E装置中生成的硝酸溶液体积为100ml,浓度为0.08mol/L,所以生成硝酸物质的量为0.008mol,根据化学方程式:3NO2+H2O=2HNO3+NO,生成的一氧化氮气体物质的量为0.004mol,在标准状况下的体积=0.004mol×22.4L/mol=0.0896L=89.6ml,加上原来试管中的氮气50ml,共计139.6ml,等于题干中实验测得的气体体积139.6ml.说明铜和浓硝酸反应的过程中生成二氧化氮气体同时没有生成一氧化氮气体;故答案为:无.
点评 本题考查了硝酸的化学性质,主要是分析装置中的气体流向和各装置的作用,需要注意的是装置测得的体积含有氮气的体积,整套装置的目的是检验铜和浓硝酸反应过程中是否有一氧化氮气体的生成,需要保证装置中不能含有氧气,才能准确测得,否则不能计算检验,需要具备扎实的基础知识和实验基本操作技能,题目较难.


科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
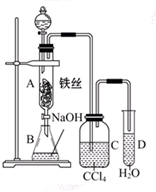 某化学课外小组查阅资料知:苯和液溴在有铁存在的条件下可发生反应生 成溴苯和溴化氢,此反应为 放热反应.他们用如图所示 装置制取溴苯.已知:溴蒸气为红棕色
某化学课外小组查阅资料知:苯和液溴在有铁存在的条件下可发生反应生 成溴苯和溴化氢,此反应为 放热反应.他们用如图所示 装置制取溴苯.已知:溴蒸气为红棕色 ,观察到A中的现象反应混合液微沸,有红棕色气体充满A容器.实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是除去溶于溴苯中的溴,写出有关反应的化学方程式Br2+2NaOH═NaBr+NaBrO+H2O.
,观察到A中的现象反应混合液微沸,有红棕色气体充满A容器.实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是除去溶于溴苯中的溴,写出有关反应的化学方程式Br2+2NaOH═NaBr+NaBrO+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 在实验室里可以用如下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质(固定装置略去).图中①为制取氯气的装置;②试管中装有15mL30%KOH溶液,并置于热水中,制取氯酸钾;③试管中装有15mL 8%NaOH溶液,并置于冰水中;④中装有紫色石蕊试液.
在实验室里可以用如下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质(固定装置略去).图中①为制取氯气的装置;②试管中装有15mL30%KOH溶液,并置于热水中,制取氯酸钾;③试管中装有15mL 8%NaOH溶液,并置于冰水中;④中装有紫色石蕊试液.| 实验现象 | 原因 |
| 溶液最初从紫色变为红色 | 氯气与水反应生成的HCl使石蕊试液变红 |
| 随后溶液逐渐变为无色 | 氯气与水反应生成HClO具有漂白性 |
| 最后溶液从无色逐渐变为浅黄绿色 | 过量氯气溶解于水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H8 | B. | C3H6 | C. | C3H4 | D. | C4H10 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com