

| 编号 | 1 | 2 | 3 | 4 |
| 溶液的体积/mL | 10.00 | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.99 | 19.98 | 17.13 | 20.03 |
分析 (1)在加热条件下,铜和浓硫酸发生氧化还原反应生成二氧化硫,所以A中发生的反应为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;打开K1,关闭K2,在C中Na2CO3和S、SO2反应生成Na2S2O3,Na2S2O3溶液具有弱碱性和较强的还原性,所以酸性条件下不能存在,二氧化硫不能完全反应且二氧化硫有毒,会污染空气,所以用NaOH吸收未反应的SO2;C中溶液的pH接近7时即停止C中的反应,打开K2,关闭K1,二氧化硫有毒,应该用B中溶液吸收二氧化硫,二氧化硫属于酸性氧化物,且有还原性,所以可以碱性物质或氧化性物质吸收二氧化硫,
①铜和浓硫酸反应生成硫酸铜和二氧化硫气体;
②根据题目Na2S2O3在酸性溶液中不能稳定存在的信息判断;
③根据过滤操作所需仪器判断;
④二氧化硫不能排放到空气中,应有尾气处理装置;
(2)①Na2S2O3反应完毕,再加入碘的标准溶液,碘与淀粉变蓝色;
②第3次实验消耗标准液的体积与其它3次相差比较大,应舍弃,1、2、4次实验的标准液平均值为消耗标准液体积,由方程式可知n(Na2S2O3•5H2O)=n(S2O32-)=2n(I2),进而计算Na2S2O3•5H2O在产品中的质量分数.
解答 解:(1)在加热条件下,铜和浓硫酸发生氧化还原反应生成二氧化硫,所以A中发生的反应为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;打开K1,关闭K2,在C中Na2CO3和S、SO2反应生成Na2S2O3,Na2S2O3溶液具有弱碱性和较强的还原性,所以酸性条件下不能存在,二氧化硫不能完全反应且二氧化硫有毒,会污染空气,所以用NaOH吸收未反应的SO2;C中溶液的pH接近7时即停止C中的反应,打开K2,关闭K1,二氧化硫有毒,应该用B中溶液吸收二氧化硫,二氧化硫属于酸性氧化物,且有还原性,所以可以碱性物质或氧化性物质吸收二氧化硫,
①浓硫酸具有强氧化性,在加热的条件下能氧化单质铜,反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
②生成的SO2和碳酸钠反应生成亚硫酸钠和CO2,由于Na2S2O3在酸性溶液中不能稳定存在,所以C中碳酸钠的作用是起反应物作用及提供碱性环境,“停止C中的反应”的操作是打开K2,关闭K1,
故答案为:Na2S2O3在酸性溶液中不能稳定存在;打开K2,关闭K1;
③过滤时的主要玻璃仪器有漏斗、烧杯、玻璃棒,故答案为:漏斗、玻璃棒、烧杯;
④SO2是大气污染物,需要尾气处理,则装置B中盛放的试剂是氢氧化钠溶液,用来吸收SO2,防止污染环境,
故答案为:NaOH;在C中的反应停止后,吸收A中产生的多余SO2,防止空气污染;
(2)①加入最后一滴I2标准溶液后,溶液变蓝,且半分钟内颜色不改变,说明Na2S2O3反应完毕,滴定到达终点,
故答案为:加入最后一滴I2标准溶液后,溶液变蓝,且半分钟内颜色不改变;
②第3次实验消耗标准液的体积与其它3次相差比较大,应舍弃,1、2、4次实验的标准液平均值为消耗标准液体积,即消耗标准液体积为$\frac{19.99+19.98+20.03}{3}$mL=20mL,由2S2O32-+I2═S4O62-+2I-,可知5.5g样品中n(Na2S2O3•5H2O)=n(S2O32-)=2n(I2)=2×0.02L×0.05mol/L×$\frac{100mL}{10mL}$=0.02mol,则m(Na2S2O3•5H2O)=0.02mol×248g/mol=4.96g,则Na2S2O3•5H2O在产品中的质量分数为$\frac{4.96g}{5.5g}$×100%=90.2%,
故答案为:90.2%.
点评 本题考查制备实验方案设计,为高频考点,侧重考查学生的分析、实验和计算能力,涉及物质制备、物质的量的计算、离子方程式书写、基本操作等知识点,明确实验原理及物质性质是解本题关键,难度中等,注意(2)②实验3数据要舍去,为易错点.


科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,氯气的摩尔体积为22.4L•mol-1 | |
| B. | 将标准状况下11.2L的HCl溶于1.0L的水中,所得溶液中HC1的浓度为O.5mol/L | |
| C. | 常温常压下,等体积的CO和H2的质量比为1:1 | |
| D. | 物质的摩尔质量在数值上等于其相对分子质量或相对原子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol•L-1盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)×(10-4mol•L-1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| C(CO)×(10-3mol•L-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
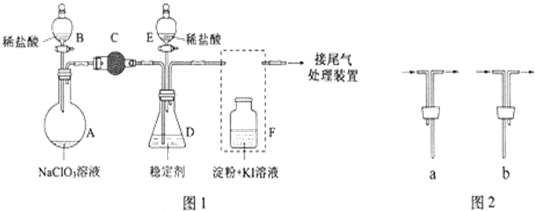
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为实现“节能减排”和“低碳经济”的一项课题是如何将CO2转化为可利用资源.目前,工业上常用CO2来生产燃料甲醇.现进行如下实验:在体积为l L的密闭恒容容器中,充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.
为实现“节能减排”和“低碳经济”的一项课题是如何将CO2转化为可利用资源.目前,工业上常用CO2来生产燃料甲醇.现进行如下实验:在体积为l L的密闭恒容容器中,充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
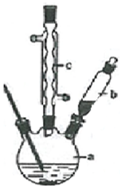 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线: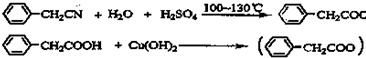
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl(s)═NH3(g)+HCl(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | 镀锌铁制品镀层破损后,铁制品比受损前更容易生锈,而镀锡铁则相反 | |
| C. | 对于N2(g)+3H2(g)?2NH3(g),当其他条件不变时,压缩气体体积使压强增大,正反应和逆反应速率以及H2的平衡转化率均增大 | |
| D. | 25℃时NH3•H2O稀溶液中,加水稀释$\frac{c({H}^{+})•c(N{H}_{3}•{H}_{2}O)}{c(N{H}_{4}^{+})}$的值增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com