
甲醇是有机化工原料合优质燃料,主要应用于精细化工、塑料等领域,也是农药、医药的重要原料之一。回答下列问题。
(1)工业上可用CO2和H2反应合成甲醇。
已知25℃、101kPa下: ①CO(g) +3H2(g)=CH3OH(l) +H2O(1) △H1=-132kJ• mol-1
②2H2(g) +O2(g)==2H2O(g) △H2= -484 kJ• mol-1
③H2O(l)= H2O(g) △H3= + 44 kJ• mol-1写出表示CH3OH燃烧热的热化学方程式:_______________。
(2)合成甲醇所需的H2可由下列反应制取:H2O(g)+CO(g) H2 (g)+CO2(g) △H<0。
H2 (g)+CO2(g) △H<0。

①在恒容密闭容器中.通入一定设的CO和H2O(g)发生上述反应,图1所示的是该反应的相关量值随溫度变化的情况,下列量值符合图示的是_______。
a.平衡常数 b.反应物的平衡转化率 c.逆反应速率 d. H2O(g)的平衡浓度
②850℃时,若通入一定量的CO和H2O(g)发生上述反应,CO和H2O(g)浓度变化如图2所示,达到平衡时H2O(g)的转化率为 ___________,该条件下的平衡常数K=___________。
(3)CO和H2反应也能合成甲醇:CO(g) +2 H2 (g) CH3OH(g) △H = -90 kJ• mol-1。恒容条件下,能使反应体系中增大的措施有_________ (任写两种)。
CH3OH(g) △H = -90 kJ• mol-1。恒容条件下,能使反应体系中增大的措施有_________ (任写两种)。
(4) 甲醇在催化剂条件下可以直接被氧化成甲酸。常温下,甲酸的电离常数Ka =1.0×10-4,20.00mL0.100 0mol·L-1NaOH溶液与等体积一定浓度的甲酸溶液混合,所得溶液中 c(HCOOH) = c(HCOO-) , c(OH-) =_______,溶液中离子浓度由大到小的顺序为_______。
(5)甲醇燃料电池(如图所示)是质子交换膜燃料电池的一种变种,它直接使用甲醇而无须预先重整。写出在该条件下,甲醇燃料电池的负极反应式:_______________。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源:2017届北京市朝阳区高三第一次(3月)综合练习理综化学试卷(解析版) 题型:选择题
某学生探究0.25mol/L Al2( SO4)3溶液与0.5mol/L Na2CO3溶液的反应,实验如下:
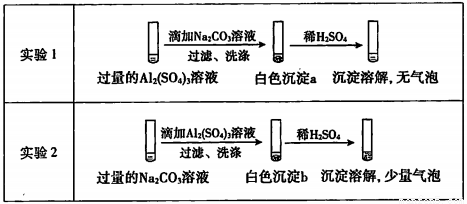
下列分析不正确的是
A. 实验I中,白色沉淀a是Al(OH)3
B. 实验2中,白色沉淀b含有CO32-
C. 实验l、2中,白色沉淀成分不同的原因与混合后溶液的pH无关
D. 检验白色沉淀a、b足否洗涤干净,均可用盐酸酸化的BaCl2溶液
查看答案和解析>>
科目:高中化学 来源:四川省成都市北湖校区2016-2017学年高一3月月考化学试卷 题型:选择题
右图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是( )

A. X与M形成的一个阴离子中含有29个电子
B. 气态氢化物沸点Y>R
C. 由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应
D. Z单质能从M与R元素构成的盐溶液中置换出单质M
查看答案和解析>>
科目:高中化学 来源:2017届全国新课程高考仿真信息理综(一)化学试卷(解析版) 题型:简答题
化学反应原理在工业生产中有广泛的应用。
(1)工业合成氨气的氢气主要来自天然气与水的反应, 但这种原料气中含有CO杂质,工业生产中通过下列反应来实现原料气中CO的除去。
CO(g)+H2O(g) CO(g)+ H2(g) △H<0。一定条件下反应达到平衡后采取_____措施可提高CO的转化率。在容积为2L的容器中发生上述反应,其中c(CO2)与反应时间(t)的关系如图甲所示,在t0时刻将容器体积扩大至4L,在图甲中画出t0时刻后。c(CO2)与反应时间(t)的变化曲线_____。
CO(g)+ H2(g) △H<0。一定条件下反应达到平衡后采取_____措施可提高CO的转化率。在容积为2L的容器中发生上述反应,其中c(CO2)与反应时间(t)的关系如图甲所示,在t0时刻将容器体积扩大至4L,在图甲中画出t0时刻后。c(CO2)与反应时间(t)的变化曲线_____。

(2)氨气的重要用途是合成尿素. 当加料比n(NH3)/n(CO2)=4时,CO2的转化率变化如图乙所示,a点v(CO2)逆______点v(CO2)正(填“大于”、“小于”或“等于”)。NH3的平衡转化率是______。
(3)某科研小组利用CO和H2在密闭容器中反应合成甲醇的实验,容器的开始体积是VL,实验中向容器中加人CO nmol, H22nmol,在一定的压强和催化剂的作用下反应:CO (g)+ 2H2(g) CH3OH(g)。右图为反应达到平衡时CO的转化率与温度、压强的关系。回答下列问题。
CH3OH(g)。右图为反应达到平衡时CO的转化率与温度、压强的关系。回答下列问题。

①上述合成甲醇的反应是______(填 “吸热”或“放热”)反应,图像中的压强p1、p2、p3的大小关系是_______。
②由图像分析压强p1温度是100℃时合成甲醇反应的平衡常数K=_______。
③在压强是p1温度是100℃的条件下,开始若向容器中加入CO 2nmol,H24nmol,反应达到平衡时CO的转化率_____(填“变大”、“变小”或“不变”),平衡时CO的物质的量_____(填“大于”、“小于”或“等于”)nmol
查看答案和解析>>
科目:高中化学 来源:2017届全国新课程高考仿真信息理综(一)化学试卷(解析版) 题型:选择题
下列叙述错误的是
A. 乙烯和苯都能使溴水褪色,褪色的原因相同
B. 淀粉、油脂、蛋白质都能水解,但水解产物不同
C. 乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别
D. 乙醇、乙酸、乙酸乙酯都能发生取代反应
查看答案和解析>>
科目:高中化学 来源:安徽省皖北协作区2017届高三第19届(3月)联考理综化学试卷 题型:选择题
下列实验的现象以及结论均正确的是
选项 | 实验 | 现象 | 结论 |
A | 将少量的氯水滴入FeBr2溶液中,再滴 加CCl4振荡 | 下层溶液呈橙红色 | 还原性:Br->Fe2+ |
B | 向某无色溶液中滴加稀盐酸酸化的BaCl2溶液 | 产生白色沉淀 | 该溶液中一定存在SO42- |
C | 某钾盐溶于盐酸,将产生的无色无味气体通入澄清石灰水 | 石灰水变浑浊 | 该钾盐是K2CO3 |
D | 在两只试管中各加入2 mL5%H2O2浓溶液,向其中一只试管中滴入2滴0.1mol/LFeCl3溶液 | 加FeCl3溶液的试管中产生的气泡快 | 催化剂能增大化学反应速率 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2017届高考信息卷(全国卷I)理科综合(一)化学试卷(解析版) 题型:填空题
甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度 | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.00 | 2.5 |
③3H2(g)+CO2(g) | K3 | ||
(1)在体积一定的密闭容器中发生反应②,达到平衡后升高温度,下列说法正确的是____________
A.平衡正向移动 B.达到新的平衡后体系的压强增大
C.H2的转化率增大 D.体系的密度增大
(2)某温度下反应①中H2的平衡转化率(α)与体系总压强(p)的关系如图所示,若开始加入2molH2和1molCO,A点时容器的体积为1L,则B点的化学平衡常数为_______。

(3)据反应①与②可推导出Kl、K2与K3之间的关系,则K3=__________。(用K1、K2表示)。500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g) 的浓度(mol/L)分别为0.8、0.1、0.3、0.15,则此时v正_______ v逆(填“> ”、“= ”或“< ")。
(4)在3L容积可变的密闭容器中发生反应②,已知c(CO)一反应时间t变化曲线l如图所示,若在t0时刻分别改变一个条件,曲线I变为曲线II和曲线III。

当曲线I变为曲线II时,改变的条件可能是________。当曲线I变为曲线III时,改变的条件可能是___________。
(5)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将a mol/L的醋酸与bmol/LBa (OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为_______。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省邯郸市高一3月月考化学试卷(解析版) 题型:选择题
根据表中提供的部分短周期元素原子半径及主要化合价的信息,判断以下叙述中正确的是( )
元素代号 | L | M | Q | R | T |
原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
A. 氢化物的沸点为H2T<H2R
B. 单质与稀盐酸反应的速率为L<Q
C. M与T形成的化合物具有两性
D. L2+与R2-的核外电子数相等
查看答案和解析>>
科目:高中化学 来源:2017届天津市部分区高三质量调查(一)化学试卷(解析版) 题型:填空题
下图是部分短周期元素化合价与原子序数的关系图,请回答下列问题:

(1)e在周期表中的位置是________,a的某种氢化物的相对分子质量是28,该氢化物的电子式为_____________。
(2)c、d、e元素的离子半径由大到小的顺序为___________(用离子符号表示);写出一个能说明f的非金属性强于e的化学方程式___________。
(3)b与氢元素按原子数2和4构成分子A的结构式为________,A是一种常用的还原剂。向装有少量AgBr的试管中加入A的溶液,可观察到固体逐渐变黑,并有气泡产生,写出该反应的化学方程式______。b与c按原子数2和4构成分子B,已知A和B反应时生成无毒害物质,则该反应中氧化剂与还原剂的物质的量之比为______。
(4)写出c、d两种元素形成的阴、阳离子数目比为1∶2的所有化合物的名称________。
(5)在100 mL b的最高价氧化物对应水化物和e的最高价氧化物对应水化物的物质的量浓度分别为0.3 mol·L-1和0.15 mol·L-1的混合液中加入2.56 g铜粉,加热,待充分反应后,所得溶液中铜离子的物质的量浓度为______。
a.0.15 mol·L-1 b.0.225 mol·L-1
c.0.30 mol·L-1 d.0.45 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com