
肼(N2H4)是火箭发动机的燃料,它与N2O4反应时,N2O4为氧化剂,生成氮气和水蒸气。已知:N2(g)+2O2(g)===N2O4(g) ΔH=+8.7 kJ/mol,N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534.0 kJ/mol,下列表示肼跟N2O4反应的热化学方程式,正确的是( )
A.2N2H4(g)+N2O4(g)===3N2(g) +4H2O(g)
ΔH=-542.7 kJ/mol
B.2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g)
ΔH=-1 059.3 kJ/mol
C.2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g)
ΔH=-1 076.7 kJ/mol
D.N2H4(g) +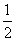 N2O4(g)===
N2O4(g)===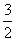 N2(g)+2H2O(g)
N2(g)+2H2O(g)
ΔH=-1 076.7 kJ/mol
科目:高中化学 来源: 题型:
X、Y、Z三种主族元素的单质在常温下都是常见的无色气体,在适当条件下三者之间可以两两发生反应生成分别是双核、三核和四核的甲、乙、丙三种分子,且乙、丙分子中含有X元素的原子个数比为2∶3。请回答下列问题:
(1)元素X的名称是____________。
(2)若甲与Y单质在常温下混合就有明显现象,则甲的化学式为________。丙在一定条件下转化为甲和乙的反应方程式为__________________________________________。
(3)①化合物丁含X、Y、Z三种元素,0.1 mol/L丁溶液的pH为1,将丁与丙按物质的量之比为1∶1混合后所得物质戊的晶体结构中含有的化学键为________(选填序号)。
a.只含共价键
b.只含离子键
c.既含离子键,又含共价键
②常温下,戊的水溶液的pH________7(填“<”“=”或“>”),其原因是________________________________________________________________________
(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
聚氯乙烯(PVC)保鲜膜的安全问题引起了广泛关注。PVC的安全隐患主要来自于塑料中残留的PVC单体以及不符合国家标准的增塑剂DEHA。工业上用乙烯和氯气为原料经下列各步合成PVC:
乙烯 甲
甲 乙
乙 PVC
PVC
(1)乙是PVC的单体,其结构简式为________________;
(2)反应③的化学方程式为________________;
(3)写出以下反应类型:
反应①________________;
反应②________________。
(4)邻苯二甲酸辛酯(DOP)是国家标准中允许使用的增塑剂之一,邻苯二甲酸 是制造DOP的原料,它跟过量的甲醇反应能得到另一种增塑剂DMP(分子式为C10H10O4),DMP属于芳香酯,其结构简式为____________________。
是制造DOP的原料,它跟过量的甲醇反应能得到另一种增塑剂DMP(分子式为C10H10O4),DMP属于芳香酯,其结构简式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某反应过程中体系的能量变化如图所示,下列说法错误的是( )
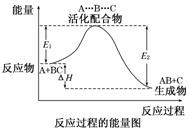
A.反应过程可表示为
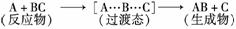
B.E1为正反应的活化能
C.正反应的热效应为ΔH=E1-E2<0,所以正反应为放热反应
D.此图中逆反应的热效应ΔH=E1-E2<0,所以逆反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:2H2(g)+O2(g)===2H2O(l)
ΔH=-574.6 kJ·mol-1
2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l)
ΔH=-1452 kJ·mol-1
H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是( )
A.H2(g)的燃烧热为574.6 kJ·mol-1
B.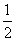 H2SO4(aq)+
H2SO4(aq)+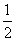 Ba(OH)2(aq)===
Ba(OH)2(aq)===
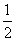 BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
C.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
D.3H2(g)+CO2(g)===CH3OH(l)+H2O(l)
ΔH=+135.9 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)深圳大运会“虹”火炬采用丙烷为燃料。丙烷热值较高,污染较小,是一种优良的燃料。试回答下列问题:
①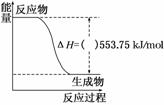 如图是一定量丙烷完全燃烧生成CO2和1 mol H2O(l)过程中的能量变化图,请在图中的括号内填入“+”或“-”。
如图是一定量丙烷完全燃烧生成CO2和1 mol H2O(l)过程中的能量变化图,请在图中的括号内填入“+”或“-”。
②写出表示丙烷燃烧热的热化学方程式:
________________________________________________________________________。
③二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1 mol二甲醚完全燃烧生成CO2和液态水放出1 455 kJ热量。若1 mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1 645 kJ热量,则混合气体中,丙烷和二甲醚的物质的量之比为________。
(2)盖斯定律认为:不管化学过程是一步完成或分几步完成,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
①已知:H2O(g)===H2O(l) ΔH1=-Q1 kJ/mol
C2H5OH(g)===C2H5OH(l) ΔH=-Q2 kJ/mol
C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g)
ΔH3=-Q3 kJ/mol
若使46 g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为_____ kJ。
②碳(s)在氧气供应不充足时,生成CO同时还部分生成CO2,因此无法通过实验直接测得反应:C(s)+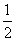 O2(g)===CO(g)的ΔH。但可设计实验、利用盖斯定律计算出该反应的ΔH,计算时需要测得的实验数据有________。
O2(g)===CO(g)的ΔH。但可设计实验、利用盖斯定律计算出该反应的ΔH,计算时需要测得的实验数据有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166 g·mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术。ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+。
(1)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是 > > 。(填化学式)
 (2)二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸在60℃时反应制得。某学生用如右图所示的装置模拟工业制取及收集ClO2,其中A为ClO2的发生装置,B为ClO2的凝集装置,C为尾气吸收装置。请问:
(2)二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸在60℃时反应制得。某学生用如右图所示的装置模拟工业制取及收集ClO2,其中A为ClO2的发生装置,B为ClO2的凝集装置,C为尾气吸收装置。请问:
①A部分还应添加温度控制装置,请你说出一种温度控制方法 ,B部分还应补充什么装置 ;
②C中的试剂为NaOH溶液,反应时生成氯酸钠和亚氯酸钠(NaClO2),发生该反应的离子方程式为 。若实验时需要450mL 4mol/L的NaOH溶液,则在精确配制时,需要称取NaOH的质量是 g,所使用的仪器除托盘天平、量筒、胶头滴管、玻璃棒外,还必须有: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
卤代烃在生产生活中具有广泛的应用,回答下列问题:
(1)多氯代甲烷常作为有机溶剂,其中分子结构为正四面体的是________。工业上分离这些多氯代甲烷的方法是________。
(2)三氟氯溴乙烷(CF3CHClBr)是一种麻醉剂,写出其所有同分异构体的结构简式:________(不考虑立体异构)。
(3)聚氯乙烯是生活中常用的塑料。工业生产聚氯乙烯的一种工艺路线如下:





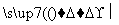

反应①的化学方程式为__________________________,反应类型为________;反应②的反应类型为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com