
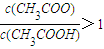
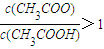 ,故B正确;
,故B正确;

科目:高中化学 来源: 题型:
电导率可用于衡量电解质溶液导电能力大小。室温下,用0.100滴定 10.00 mL 浓度均为 0.100 mol/L HCl和CH3COOH的混合溶液,所得曲线如右图所示。下列说法正确的是()
A. ①点溶液中C(H+)为
B. 溶液温度高低为①〉③〉②
C. ③点溶液中有
D. ③点后因离子数目减少使溶液电导率略降低
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题冲刺第7讲 水溶液中的离子平衡练习卷(解析版) 题型:选择题
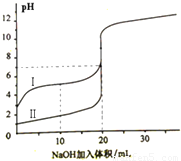
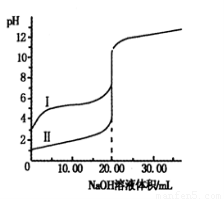
室温下,用0.100 mol/L NaOH 溶液分别滴定20.00 mL 0.100 mol/L的盐酸和醋酸,滴定曲线如下图所示。下列说法正确的是(?? )
A.Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线
B.V(NaOH)=10.00 mL 时, >1
>1
C.pH=7时,两种酸所用NaOH溶液的体积相等
D.V(NaOH)=20 .00 mL 时,c(Cl-)<c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年福建省莆田市高三3月质量检测化学试卷(解析版) 题型:选择题
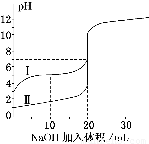
室温下,用0.100 0 mol·L-1NaOH溶液分别滴定体积均为20.00 mL的盐酸和醋酸溶液,滴定曲线如右图。下列说法正确的是
A.I、Ⅱ分别表示盐酸和醋酸的滴定曲线
B.盐酸和醋酸的浓度均为0.100 0 mol·L-1
C.pH=7时,两种酸所消耗NaOH溶液的体积相等
D.V(NaOH)=20.00mL时,c(Cl一)=c(CH3COO一)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省威海市高三下学期第一次模拟考试化学试卷(解析版) 题型:选择题
室温下,用0.100 mol/L NaOH 溶液分别滴定20.00 mL 0.100 mol/L的盐酸和醋酸,
下列说法正确的是
A.起始时盐酸和醋酸溶液PH相同
B.V(NaOH)=10.00 mL 时,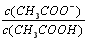 <1
<1
C.pH=7时,两种酸所用NaOH溶液体积不相等,醋酸用的体积多
D.V(NaOH)=20 .00 mL 时,c(Cl?)>c(CH3COO—)
查看答案和解析>>
科目:高中化学 来源:2011-2012学年安徽省江南十校高三素质教育联考理科综合试卷化学部分(解析版) 题型:选择题
电导率可用于衡量电解质溶液导电能力大小。室温下,用0.100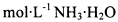 滴定 10.00 mL 浓度均为 0.100 mol/L HCl和CH3COOH的混合溶液,所得曲线如右图所示。下列说法正确的是()
滴定 10.00 mL 浓度均为 0.100 mol/L HCl和CH3COOH的混合溶液,所得曲线如右图所示。下列说法正确的是()
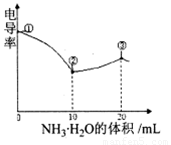
A. ①点溶液中C(H+)为
B. 溶液温度高低为①〉③〉②
C. ③点溶液中有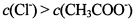
D. ③点后因离子数目减少使溶液电导率略降低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com