
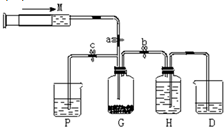
 某课外活动小组利用如图所示装置制取氯气.提供的试剂有:浓盐酸、饱和食盐水,氢氧化钠溶液、高锰酸钾固体.反应的化学方程式为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
某课外活动小组利用如图所示装置制取氯气.提供的试剂有:浓盐酸、饱和食盐水,氢氧化钠溶液、高锰酸钾固体.反应的化学方程式为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O分析 (1)氯气易溶于水,在饱和氯化钠溶液中溶解度较小;
(2)由题意可知用仪器A吸收过量的氯气;
(3)氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水;
(4)根据反应原理只有浓盐酸才反应,随着反应的进行盐酸要变稀,所以氯化氢不可能全部反应;
解答 解:(1)氯气易溶于水,在饱和氯化钠溶液中溶解度较小,所以可以用排饱和食盐水的方法收集氯气,装置C中为饱和食盐水,
故答案为:饱和NaCl溶液;
(2)由题意可知用仪器A吸收过量的氯气,要想使反应剩余气体进入A,应关闭弹簧夹a和弹簧夹b,打开弹簧夹c;
故答案为:b;c;
(3)氯气有毒,所以不能直接排空,氯气和水能反应生成酸,酸和碱反应,所以可用碱液吸收氯气,氯气和碱反应生成盐、次氯酸盐、水,方程式:Cl2+2NaOH=NaCl+NaClO+H2O;
故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
(4)依据2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,若0.032mol HCl全部反应,则生成氯气物质的量为0.01mol,但是根据反应原理只有浓盐酸才反应,随着反应的进行盐酸要变稀,稀盐酸不能与高锰酸钾反应,所以实际产生氯气物质的量小于0.01mol;
故答案为:小于.
点评 本题考查了氯气的制法和有关氧化还原的计算,题目难度中等,熟悉物质的性质和制备原理,明确氧化还原反应的规律是解题关键,注意盐酸浓度对反应的影响.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①⑥ | C. | ③④⑤ | D. | ①②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=12的Ba(OH)2溶液 | B. | pH=12的氨水 | ||
| C. | 0.01mol/L AgNO3溶液 | D. | 0.005mol/L NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 碳酸钠在不同温度下可以失去部分或全部的结晶水,现有一种碳酸钠晶体(Na2CO3•nH2O)样品,可采用在不同温度下加热样品(温度逐渐升高)来测定其组成.
碳酸钠在不同温度下可以失去部分或全部的结晶水,现有一种碳酸钠晶体(Na2CO3•nH2O)样品,可采用在不同温度下加热样品(温度逐渐升高)来测定其组成.
| 称量次序 | 加热温度(℃) | 容器+试样质量(g) |
| Ⅰ | 常温 | 62.2 |
| Ⅱ | T1 | 56.8 |
| Ⅲ | T2 | 49.6 |
| Ⅳ | T3 | 44.2 |
| Ⅴ | T4 | 44.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾的化学式为:KAl(SO4)2 | |
| B. | 氯离子的结构示意图为: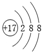 | |
| C. | 纯碱的化学式:NaCO3 | |
| D. | 氨水的电离方程式:NH3•H2O→NH4++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 A+3 B→2 C | B. | A+3 B→2 C | C. | 3 A+B→2 C | D. | A+B→C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaClO3是还原剂 | |
| B. | 氧化性:ClO2>NaClO3 | |
| C. | 化学反应方程式为:2NaClO3+Na2SO3+H2SO4=2ClO2+2Na2SO4+H2O | |
| D. | 1 mol NaClO3参加反应有2 mol e-转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com