
【题目】将AgCl分别加入盛有:①5 mL水;② 6 mL0.5mol·L-1 NaCl溶液;③10 mL0.2mol·L-1 CaCl2溶液;④50 mL0.1mol·L-1盐酸的烧杯中,均有固体剩余,各溶液中c(Ag+)从大到小的顺序排列正确的是
A. ④③②① B. ②③④① C. ①④③② D. ①③②④
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:
【题目】若有A、B、C三种烃的衍生物,相互转化关系如下:
1,2二溴乙烷![]() 气体D
气体D![]() A
A![]() B
B![]() C
C
C跟石灰石反应产生使澄清石灰水变浑浊的气体。
(1)A、B、C中所含官能团的名称是 、 、 。
(2)书写下列反应的化学方程式
A→B的化学方程式为: ___________________
B→C的化学方程式为: ___________________
B→A的化学方程式为: ___________________
(3)上述A、B、C、D四种物质还原性最强的是 (填名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读题目,回答问题。
(1)已知: P4(s)+6Cl2(g)=4PCl3(g) ΔH=akJ·mol-1, P4(s)+10Cl2(g)=4PCl5(g) ΔH=b kJ·mol-1,P4具有正四面体结构,PCl5中P—Cl键的键能为c kJ·mol-1,PCl3中P—Cl键的键能为1.2c kJ·mol-1。请回答:PCl3(g)和氯气反应生成PCl5(g)的热化学方程式为________________________________,Cl—Cl 键的键能为_________________________。
(2)离子液体是一种室温熔融盐非水体系。由有机阳离子、Al2Cl7-利AlCl4-组成的离子液体作电解液时,可在钢制品上电镀铝。则钢制品应接电源的__________极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为_________________________。
(3)人工肾脏可用间接电化学方法除去代谢产物中的尿素,原理如图
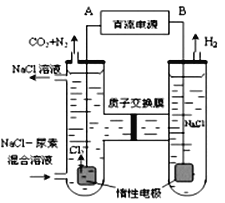
①电源的负极为_____________(填“A”或“B”)。
②阳极室中发生的反应为_____________________,______________________。
③电解结束后,阴极室溶液的pH 与电解前相比将____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用NaHCO3和KHCO3组成的混合物进实验,测得的实验数据如下表所示(盐酸的物质的量浓度相同):(计算结果保留3位有效数字)
实验编号 | ① | ② | ③ |
盐酸体积(mL) | 50 | 50 | 50 |
混合物的质量(g) | 9.2 | 15.7 | 27.6 |
标准状况下CO2的体积(L) | 2.24 | 3.36 | 3.36 |
回答下列问题:
(1)由实验______________(填实验编号)可判断盐酸完全反应,理由是_____________。
(2)盐酸的物质的量浓度为__________________。
(3)产生标准状况下3.36LCO2所需固体的质量为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室进行铁盐与亚铁盐相互转化实验。
实验I:將Fe3+转化为Fe2+

(1)Fe3+与Cu粉发生反应的离子方程式为___________________________。
(2)探究白色沉淀产生的原因,请填写实验方案:
实验方案 | 现象 | 结论 |
步骤1:取4mL____mol/LCuSO4溶液,向其中滴加3滴0.1mol/LKSCN溶液 | 产生白色沉淀 | CuSO4溶液与KSCN溶液 反应产生了白色沉淀 |
取______________ | 无明显现象 |
查阅资料:
已知:①SCN-的化学性质与I-相似 ②2Cu2++4I-=2CuI↓+I2
Cu2+与SCN-反应的离子方程式为_________________________________。
实验II:将Fe2+转化为Fe3+
实验方案 | 现象 |
向3mL0.lmol/LFeSO4溶液中加入1mL 稀硝酸 | 溶液变为棕色,放置一段时间后, 棕色消失,溶液变为黄色 |
探究上述现象出现的原因:
查阅资料:Fe2++NO![]() Fe(NO)2+(棕色)
Fe(NO)2+(棕色)
(3)用离子方程式解释NO产生的原因_____________________________________。
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应I:Fe2++与HNO3反应; 反应II:Fe2+与NO反应
①依据实验现象,可推知反应I的速率比反应II_____(填“快”或“慢”)。
②反应I是一个不可逆反应,设计实验方案加以证明_________________________。
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、Q、R皆为前20号元素,其原子半径与主要化合价的关系如图所示。下列说法错误是

A. Q位于第三周期IA族
B. X、Y、Z三种元素组成的化合物可能是盐或碱
C. 简单离子半径:M->Q+>R2+
D. Z与M的最高价氧化物对应水化物均为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氢键的下列说法中正确的是( )
A. 每个水分子内含有两个氢键
B. 在单个水分子、水蒸气、液态水、冰中都存在氢键
C. 分子间能形成氢键使物质的熔沸点升高
D. HF的热稳定性很强,是因为其分子间能形成氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氧磷(POCl3)常用作半导体掺杂剂及光导纤维原料。某化学小组用PCl3氧化法制备POCl3的装置如下图所示。已知:POCl3的沸点是105.1℃,PCl3 的沸点是65.5℃;二者遇潮湿空气都易生成酸雾。

(1)仪器a的名称为_______________。
(2)装置A是氧气的发生装置,试写出A中发生反应的化学方程式:___________________。
(3)装置B的作用是______________________________________________________________。
(4)装置C中反应温度应控制在60~65℃,原因是_____________________________________。
(5)通过佛尔哈德法可以测定POCl3产品中氯元素的质量分数,实验步骤如下:
Ⅰ.取1.5000g 产品于锥形瓶中,加入足量NaOH溶液,待完全水解后加稀硝酸调至酸性。
Ⅱ.向锥形瓶中加入3.2000mol·L-1的AgNO3溶液10.00mL,使Cl-完全沉淀。
Ⅲ.向其中加入2.00mL硝基苯,用力摇动,使沉淀表面被硝基苯覆盖。
Ⅳ.加入指示剂,用0.2000mol·L-1NH4SCN标准溶液滴定过量Ag+至终点,消耗10.00mLNH4SCN溶液。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2.0×10-12。
①滴定选用的指示剂是________(填代号)。
a.FeCl2 b.NH4Fe(SO4)2 c.淀粉 d.甲基橙
②实验过程中加入硝基苯的目的是_____________________________,若无此操作所测氯元素的质量分数将会________(填“偏大”、“偏小” 或“不变”)。
③产品中氯元素的质量分数为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com