
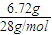 =0.24mol,在氧气足量时,全部发生反应生成二氧化碳和水,根据方程式2CO+O2
=0.24mol,在氧气足量时,全部发生反应生成二氧化碳和水,根据方程式2CO+O2 2CO2,一氧化碳与二氧化碳物质的量相等,Na2O2与CO2反应2CO2+2Na2O2=2Na2CO3+O2,质量增重△m为2Na2CO3-2Na2O2=2CO,可知,反应后固体质量增加量为CO的质量;2H2+O2
2CO2,一氧化碳与二氧化碳物质的量相等,Na2O2与CO2反应2CO2+2Na2O2=2Na2CO3+O2,质量增重△m为2Na2CO3-2Na2O2=2CO,可知,反应后固体质量增加量为CO的质量;2H2+O2 2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应2H2O+2Na2O2=4NaOH+O2,质量增重△m为2H2O-O2=2H2,可知,反应后固体增加的质量为氢气质量,甲醛可以看成是一氧化碳和氢气的混合物,所以甲醛与足量的氧气充分反应后的产物通过足量的Na2O2粉末,使Na2O2粉末增重的质量为甲醛的全部质量,即当HCHO、H2和CO三种气体组成的混合气体足量的氧气充分反应后的产物通过足量的Na2O2粉末,使Na2O2粉末增重的质量为混合气体的总质量.
2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应2H2O+2Na2O2=4NaOH+O2,质量增重△m为2H2O-O2=2H2,可知,反应后固体增加的质量为氢气质量,甲醛可以看成是一氧化碳和氢气的混合物,所以甲醛与足量的氧气充分反应后的产物通过足量的Na2O2粉末,使Na2O2粉末增重的质量为甲醛的全部质量,即当HCHO、H2和CO三种气体组成的混合气体足量的氧气充分反应后的产物通过足量的Na2O2粉末,使Na2O2粉末增重的质量为混合气体的总质量.

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
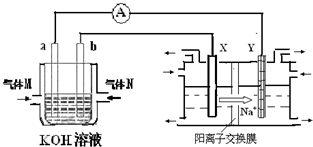 化学在能源开发与利用中起到十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
化学在能源开发与利用中起到十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.| 1 |
| 2 |
| 1 |
| 2 |
| 物质的量/(mol)/时间(h) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源:河南省期末题 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com