
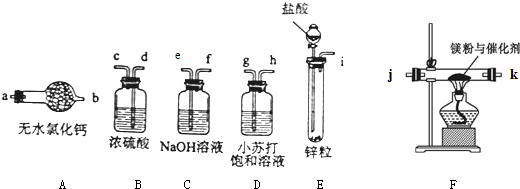
分析 (1)制备氢化镁的原料是镁粉和氢气,用盐酸和锌制取氢气,氢气中混有HCl和水蒸气,先通过氢氧化钠溶液除去HCl,再通过浓硫酸除去水蒸气,即可得到纯净的氢气,氢气和镁在催化剂的作用下制得氢化镁,为防止空气中的水蒸气进入反应装置,应在最后加一个干燥管;
(2)有气体参加加热或燃烧的反应需要首先验纯,实验完毕后先熄火、冷却,再停止气体生成,防止倒吸发生爆炸;
(3)有气泡冒出为氢气,氢化镁和水反应,反应物为氢化镁和水,生成物为氢气和氢氧化镁,据此书写方程式;
(4)氢化镁易发生水解,无水氯化钙具有吸水性,能防止空气中的水蒸气进入玻璃管中,装置气密性检验的原理是:通过气体发生器与液体构成封闭体系,依据改变体系内压强时产生的现象(如气泡的生成、水柱的形成、液面的升降等)来判断装置气密性的好坏;一般用到的方法有:空气热胀冷缩法、注水法等;
(5)氢化钠与氢化镁都能与水反应生成氢气,但氢化钠与水反应生成易溶于水的氢氧化钠,而氢化镁与水反应生成难溶于水的氢氧化镁.
解答 解:(1)制备MgH2固体需要制备氢气和镁发生反应,MgH2在干燥的空气中能稳定存在,遇水或酸能够引起燃烧,所以制备得到的氢气必须干燥纯净,利用E装置制备氢气(i ),氯化氢易挥发,制得的氢气中含有氯化氢和水蒸气,先通过氢氧化钠溶液除去HCl(e f),再通过浓硫酸除去水蒸气(d c,注意洗气长管进短管出),即可得到纯净的氢气,氢气和镁在催化剂的作用下制得氢化镁(j k,jk可颠倒),为防止空气中的水蒸气进入反应装置,应在最后加一个干燥管,( a,粗管进连气体流入,细管出防止空气中的水蒸气进入),所以装置连接顺序为:i e f d c j k a (jk可颠倒),
故答案为:i e f d c j k a (jk可颠倒);
(2)有气体参加加热或燃烧的反应需要首先验纯(C),加热反应一段时间 (a),实验完毕后先熄火、冷却,再停止气体生成,防止倒吸发生爆炸,停止加热,充分冷却(d),关闭分液漏斗活塞(b),故正确的操作顺序为cadb,
故答案为:cadb;
(3)有气泡冒出为氢气,根据原子守恒,氢化镁和水反应,方程式为:MgH2+2H2O=Mg(OH)2↓+2H2↑,
故答案为:MgH2+2H2O=Mg(OH)2↓+2H2↑;
(4)氢化镁易发生水解,无水氯化钙具有吸水性,所以无水氯化钙的作用是防止空气中的水蒸气进入玻璃管中,使氢化镁发生水解反应而失效,装置气密性检验的原理是:通过气体发生器与液体构成封闭体系,依据改变体系内压强时产生的现象(如气泡的生成、水柱的形成、液面的升降等)来判断,方法①:检验E装置的气密性时,关闭分液漏斗活塞,将导管的出口浸入水槽的水中,手握住烧瓶,有气泡从导管口逸出,放开手后,有少量水进入导管,表明装置不漏气.方法②:用弹簧夹夹住i处橡胶管,从漏斗注入一定量的水,使漏斗中的水面高于烧瓶内的水面.停止加水后,漏斗内与烧瓶中的液面差保持不变,说明装置不漏气.
故答案为:防止空气中的水蒸气进入玻璃管中,使氢化镁发生水解反应而失效;方法①:检验E装置的气密性时,关闭分液漏斗活塞,将导管的出口浸入水槽的水中,手握住烧瓶,有气泡从导管口逸出,放开手后,有少量水进入导管,表明装置不漏气.方法②:用弹簧夹夹住i处橡胶管,从漏斗注入一定量的水,使漏斗中的水面高于烧瓶内的水面.停止加水后,漏斗内与烧瓶中的液面差保持不变,说明装置不漏气;
(5)氢化钠与氢化镁都能与水反应,反应分别为:NaH+H2O=NaOH+H2↑,MgH2+2H2O=Mg(OH)2↓+2H2↑,都生成氢气,但氢化钠与水反应生成易溶于水的氢氧化钠,而氢化镁与水反应生成难溶于水的氢氧化镁,将少许固体放入适量水中,如果出现浑浊,则为MgH2,如果不出现浑浊,则为NaH,
故答案为:将少许固体放入适量水中,如果出现浑浊,则为MgH2,如果不出现浑浊,则为NaH.
点评 本题考查了氢化镁的制备实验,实验装置的连接顺序和分析判断是解答的难点,掌握物质的性质以及制备的原理是解答关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 空气中的污染物主要来源为燃煤、机动车尾气等.因此,CO、SO2、NOx等进行研究具有重要意义.请回答下列问题:
空气中的污染物主要来源为燃煤、机动车尾气等.因此,CO、SO2、NOx等进行研究具有重要意义.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
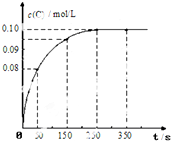 在一定温度下,向2L恒容密闭容器中充入1mol A,发生A(g)?B(g)+C(g)反应.反应过程中c(C) 随时间变化的曲线如图所示,下列说法不正确的是( )
在一定温度下,向2L恒容密闭容器中充入1mol A,发生A(g)?B(g)+C(g)反应.反应过程中c(C) 随时间变化的曲线如图所示,下列说法不正确的是( )| A. | 反应在0~50s的平均速率v(C)=1.6×10-3mol/(L•s) | |
| B. | 该温度下,反应的平衡常数K=0.025 | |
| C. | 保持其他条件不变,升高温度,平衡时c(B)=0.11mol/L,则该反应的△H<0 | |
| D. | 反应达平衡后,再向容器中充入 1 mol A,该温度下再达到平衡时0.1mol/L<c(C)<0.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙醇可用来制取乙醛、乙醚、乙酸乙酯等化工原料,也是制取染料、涂料、洗涤剂等产品的原料.
乙醇可用来制取乙醛、乙醚、乙酸乙酯等化工原料,也是制取染料、涂料、洗涤剂等产品的原料.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 变化过程 | △H | △S |
| 4Fe(s)+3O2(g)=2Fe2O3(s) | <0 | |
| CaCO3(s)分解为CaO(s)和CO2(g) |
| 时间/min | A | B | C | D |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t1~t2 | t3~t4 | t5~t6 | t6~t7 |
| K1 | K2 | K3 | K4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④③②①⑤ | B. | ④⑤③②① | C. | ④③①②⑤ | D. | ④②③①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在空气中,金属银的表面生成一层黑色物质 | |
| B. | 镀银的铁制品,镀层部分受损后,露出的铁表面易被腐蚀 | |
| C. | 埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更易被腐蚀 | |
| D. | 为保护海轮的船壳,常在船壳上镶入锌块 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com