
【题目】在密闭容器中,反应X2(g)+Y2(g)2XY(g)△H<0达到甲平衡,仅改变某一条件后,达到乙平衡.对此过程的分析正确的是( ) 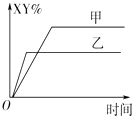
A.可能是减小了反应物的浓度,反应物X2转化率一定减小
B.可能是加入了催化剂,反应物X2百分含量(X2%)将增大
C.可能是缩小了容器的体积,但该反应的平衡常数保持不变
D.可能是升高了温度,该反应的平衡常数一定减小
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图表示从固体混合物中分离X的2种方案,请根据方案Ⅰ与方案Ⅱ指出下列说法不合理的是( ) 
A.可以选用方案Ⅰ分离NaCl中的I2
B.方案Ⅰ中X物质不可能是受热易分解的物质
C.方案Ⅱ中加入NaOH溶液可以分离出含SiO2的Fe2O3
D.方案Ⅱ中加入的也可以是能够溶解除X外的其余物质的试剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是( )
A.反应物的总能量高于生成物的总能量时,该反应常温下即可发生
B.氢气燃烧热为285.8kJmol﹣1 , 则有H2(g)+1/2O2(g)=H2O(g)△H=﹣285.8kJmol﹣1
C.将1molBa(OH)2的稀溶液与稀盐酸完全中和,放出114.6kJ的热量,热化学方程式为:OH﹣(aq)+H+(aq)=H2O(l)△H=﹣114.6kJmol﹣1
D.2SO2(g)+O2(g)2SO3(g);△H=﹣QkJmol﹣1(Q>0),则将2molSO2(g)和足量O2置于一密闭容器中,充分反应后放出的热量一定小于QkJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室用于盛放碱性试剂的试剂瓶不用磨口玻璃塞的原因是(用离子方程式表示):______________________________;玻璃试剂瓶不能盛放氢氟酸的原因是(用化学方程式表示):_____________________________________。
(2)实验室中的Na2SiO3溶液长期放置,瓶底会出现白色沉淀,则形成沉淀的离子方程式是___________________________。取瓶中的上层清液加入稀盐酸,观察到既有气泡产生又有沉淀生成,其离子方程式分别为_____________________________________。用Na2SiO3溶液浸泡过的棉花不易燃烧,体现Na2SiO3的用途可做___________________的原料。
(3)某溶液中有NH4+、Mg2+、Fe2+、Fe3+、Al3+五种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是__________,有所增加的阳离子是___________。
A. NH4+ B. Mg2+ C. Fe2+ D. Al3+ E. Fe3+
(4)质量相同的H216O和D216O所含质子数之比为 _______________, 中子数之比为____________。
(5)A2-原子核内有x个中子,其质量数为m,则n g A2-所含电子的物质的量为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到目的的是( )
A.用溴水鉴别苯和正己烷
B.用BaCl2溶液鉴别SO42-和SO32-
C.用浓HNO3与Cu反应制备NO2
D.将混有HCl的Cl2通入饱和NaHCO3溶液中除去HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是 ( )
A. 摩尔是七个基本物理量之一 B. 阿伏加德罗常数是没有单位的
C. 1molH2O约含有6.02×1023 个水分子 D. 氮气的摩尔质量是28g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色透明的酸性溶液中,可大量共存的溶液是 ( )
A. Cu2+、Ca2+、Cl、NO3B. Mg2+、SO42-、NH4+、Cl-
C. K+、Na+、HCO3-、Cl-D. K+、MnO4、Cl、S2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯及其化合物对人类生产及生活有重要作用。
(1)氯的原子结构示意图为_______;实验室氯气的尾气处理常用NaOH溶液,请用离子方程式表示该反应:________;工业上将氯气通入冷的消石灰制取漂白粉,漂白粉的有效成分是___(填化学式)。
(2)NaClO2的漂白能力是漂白粉的4到5倍。NaClO2广泛用于造纸工业、污水处理等。工业上生产NaClO2的工艺流程如下:
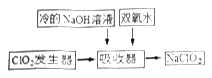
①发生器中用NaClO3与Na2SO3在酸性环境下反应制备ClO2,则氧化剂与还原剂的物质的量之比为:_____________。
②吸收器中生成NaClO2反应的离子方程式为_______,吸收器中的反应温度不能过高,可能的原因为__________。
③Cl2和ClO2均能将工业废水中得CN-氧化成无毒的物质,而自身被还原为Cl-,则处理相同量的CN-所需Cl2的质量是ClO2的多少倍。______(计算结果保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机化学反应方程式书写及反应类型均正确的是( )
A.CH2=CH2+HCl ![]() CH3CH2Cl????????????????????? 加聚反应
CH3CH2Cl????????????????????? 加聚反应
B.CH3COOH+CH3CH2OH ![]() CH3COOCH2CH3+H2O??? 酯化反应
CH3COOCH2CH3+H2O??? 酯化反应
C.![]() ??????????? 加成反应
??????????? 加成反应
D.![]() ??????????? 取代反应
??????????? 取代反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com