
【题目】下列分子或离子中,能提供孤对电子与某些金属离子形成配位键的是( )
①H2O ②NH3 ③Cl- ④CN- ⑤CO
A. ①② B. ①②③ C. ①②④ D. ①②③④⑤
科目:高中化学 来源: 题型:
【题目】CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式为:
①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣890.3kJmol﹣1
②2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJmol﹣1
③C(s)+O2(g)═CO2(g)△H=﹣393.5kJmol﹣1
(1)在深海中存在一种甲烷细菌,它们依靠酶使甲烷与O2作用产生的能量存活,甲烷细菌使1mol甲烷生成CO2气体与液态水,放出的能量(填“>”“<”或“=”)890.3kJ.
(2)甲烷与CO2可用于合成合成气(主要成分是一氧化碳和氢气):CH4+CO2═2CO+2H2 , 1g CH4完全反应可释放15.46kJ的热量,则:
①能表示该反应过程中能量变化的是(图1)(填字母).
②若将物质的量均为1mol的CH4与CO2充入某恒容密闭容器中,体系放出的热量随着时间的变化如图2所示,则CH4的转化率为 . 
(3)C(s)与H2(g)不反应,所以C(s)+2H2(g)═CH4(g)的反应热无法直接测量,但通过上述反应可求出C(s)+2H2(g)═CH4(g)的反应热△H= .
(4)目前对于上述三种物质的研究是燃料研究的重点,下列关于上述三种物质的研究方向中可行的是(填字母).
A.寻找优质催化剂,使CO2与H2O反应生成CH4与O2 , 并放出热量
B.寻找优质催化剂,在常温常压下使CO2分解生成碳与O2
C.寻找优质催化剂,利用太阳能使大气中的CO2与海底开采的CH4合成合成气(CO、H2)
D.将固态碳合成为C60 , 以C60作为燃料
(5)工业上合成甲醇的反应:CO(g)+2H2(g)CH3OH(g)△H=﹣90.8kJmol﹣1 , 若在温度相同、容积均为2L的3个容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时如表:
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1molCO、2mol H2 | 1mol CH3OH | 2mol CO、4mol H2 |
CH3OH的浓度(mol/L) | c1=0.25 | c2 | c3 |
反应的能量变化 | 放出Q1 kJ | 吸收Q2 kJ | 放出Q3 kJ |
平衡常数 | K1 | K2 | K3 |
反应物转化率 | α1 | α2 | α3 |
①下列不能说明该反应在恒温恒容条件下已达化学平衡状态的是 .
A.v正(H2)=2v逆(CH3OH) B.n(CO)﹕n(H2)﹕n(CH3OH)=1﹕2:1
C.混合气体的密度不变 D.混合气体的平均相对分子质量不变 E.容器的压强不变
②下列说法正确的是 .
A.c1=c2 B.Q1=Q2 C.K1=K2 D.α2+α3<100%
③如图表示该反应的反应速率v和时间t的关系图(图3):
各阶段的平衡常数如表所示:
t2~t3 | t4~t5 | t5~t6 | t7~t8 |
K4 | K5 | K6 | K7 |
K4、K5、K6、K7之间的关系为(填“>”、“<”或“=”).反应物的转化率最大的一段时间是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式的书写正确的是
A.CuCl2=Cu +Cl2↑B.Na2CO3=2Na++CO32-
C.H2SO4=2H++S6++4O2-D.Ba(OH)2=Ba +2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像分别表示有关反应的反应过程与能量变化的关系。
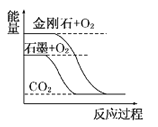

据此判断下列说法中正确的是( )
A. 石墨转变为金刚石是吸热反应 B. 白磷比红磷稳定
C. S(g)+O2(g)===SO2(g) ΔH1S(s)+O2(g)=SO2(g) ΔH2 则ΔH1>ΔH2 D. CO(g)+H2O(g)=CO2(g)+H2(g) ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在酸性溶液中,可大量共存的离子是( )
A.K+ Na+ OH﹣ SO42﹣
B.Mg2+ SO42﹣ NH4+ Cl﹣
C.K+ Na+ HCO3﹣ Cl﹣
D.K+ Na+ NO3﹣ CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是分子式为C7H8的芳香烃,已知它存在以下一系列转化关系,其中C是一种一元醇,D是A的对位一取代物,H与E、I与F分别互为同分异构体:
(1)化合物I的结构简式是 ,
(2)反应B﹣→C的化学方程式是: , 反应E﹣→F的化学方程式是: .
(3)设计实验证明H中含有溴原子,还需用到的试剂有 .
(4)为验证E﹣→F的反应类型与E﹣→G不同,下列实验方法切实可行的是 .
A.向E→F反应后的混合液中加入硝酸酸化,再加入AgNO3溶液得到淡黄色沉淀
B.向E→F反应后的混合液中加入溴水,发现溴水立即褪色
C.向E→F反应后的混合液中加入盐酸酸化后,加入溴的CCl4溶液,使之褪色
D.向E→F反应后的混合液中加入酸性KMnO4溶液,混合液红色变浅.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2是一种绿色试剂,在化学工业中用于生产过氧乙酸、亚氯酸钠等的原料,医药工业用作杀菌剂、消毒剂。某化学小组为探究H2O2的性质做了如下实验:
(1) 下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据。

研究小组在设计方案时,考虑了浓度、____、____因素对过氧化氢分解速率的影响。
(2) 另一研究小组拟在同浓度 Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响。限选试剂与仪器:30% H2O2、0.1 mol·L-1FeCl3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器。设计实验装置,完成图1方框内的装置示意图(要求所测得的数据能直接体现反应速率大小)。________


图1 图2
(3) 对于H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和 Cu2+对H2O2分解的催化效果,研究小组的同学设计了如图2所示的实验。请回答相关问题:
①可通过观察________,比较得出结论。
②有同学提出将0.1 mol·L-1FeCl3溶液改为0.05 mol·L-1Fe2(SO4)3更为合理,其理由是___。
(4) 已知 FeCl3溶液中主要含有H2O、Fe3+和 Cl-三种微粒,甲同学又做了两种猜想。
猜想 1:真正催化分解H2O2的是FeCl3溶液中的 Fe3+。
猜想 2:真正催化分解H2O2的是____。
完成表格验证猜想:
所需试剂 | 操作及现象 | 结论 |
_______ | _________ | Cl-对H2O2分解无催化作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)羟基的电子式是
(2)写出2,4,6﹣三硝基甲苯的结构简式
(3)![]() 的系统命名是:
的系统命名是:
(4) 的键线式是
的键线式是
(5) 的单体结构简式为:
的单体结构简式为:
(6)苯与浓硫酸、浓硝酸的混合酸在60℃时发生取代反应:
(7)丙烯在催化剂的条件下制取聚丙烯的反应方程式:
(8)2﹣溴丙烷→丙烯的反应方程式: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com