若有0.03mol铜完全溶于硝酸,产生氮的氧化物NO、NO2和N2O4的混合气体共0.05mol。该混合气体的平均相对分子质量可能是()。
A.30 B.46 C. 50 D. 66
BC
【试题分析】
以从两个极端来考虑。假设一种情况为混合气体中没有N2O4时,设NO的物质的量为x,则NO2的物质的量为0.05mol-x,根据电子得失守恒,铜失去的电子数等于NO3-得到的电子数,所以有0.03mol×2=3x+(0.05mol-x)×1,得:x=0.005mol,NO2的物质的量为0.05mol-0.005mol=0.045mol,所以混合气体的平均相对分子质量为(30×0.005+46×0.045)/0.05=44.4;同理,假设另一种情况为混合体中没有NO时,混合气体的平均相对分子质量为55.2。所以该混合气体的平均相对分子质量应在44.4~55.2之间。故答案选BC。



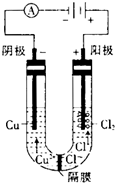 如图为细菌冶铜和火法冶铜的主要流程.
如图为细菌冶铜和火法冶铜的主要流程.