
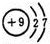
分析 I.前四周期原子序数依次增大的元素A、B、X、D中,A为电负性最大的元素,则A为F元素;B为前四周期第一电离能最小的元素,则B为K元素;与B位于同一周期的X和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2,且C和D的原子序数大于K,C的原子序数小于D,则C是Fe元素,D是Ni元素;
Ⅱ.(6)取CoCl3•6NH3(黄色)和CoCl3•5NH3(紫红色)两种化合物各1mol,分别溶于水,加入足量硝酸银溶液,产生氯化银沉淀的量分别为3mol和2mol,钻的配位数为6.则CoCl3•6NH3中离子均处于外界,其结构简式为[Co(NH3)6]Cl3 ;
(7)①已知CN-与N2结构相似,CN-中C、N原子之间形成C≡N键;
②沉淀溶解生成K4[Fe(CN)6]
解答 解:I.前四周期原子序数依次增大的元素A、B、X、D中,A为电负性最大的元素,则A为F元素;B为前四周期第一电离能最小的元素,则B为K元素;与B位于同一周期的X和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2,且C和D的原子序数大于K,C的原子序数小于D,则C是Fe元素,D是Ni元素.
(1)A为F元素,原子结构示意图为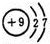 ,故答案为:
,故答案为: ;
;
(2)元素A和B形成的化合物为KF,其晶体类型为:离子晶体,故答案为:离子晶体;
(3)元素X的电离能:I2<I3,故答案为:<;
(4)Fe2+价电子排布式为3d6,失去1个电子后生成Fe3+价电子排布式为3d5,3d能级达到半充满的稳定状态,Fe2+易被氧化为Fe3+,
故答案为:Fe2+价电子排布式为3d6,失去1个电子后生成Fe3+价电子排布式为3d5,3d能级达到半充满的稳定状态;
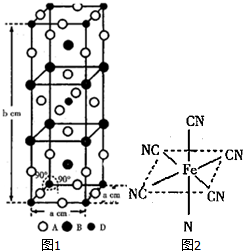
(5)①该晶胞中F原子个数=16×4+4×$\frac{1}{2}$+2=8,K原子个数=8×$\frac{1}{4}$+2=4,Ni原子个数=8×$\frac{1}{8}$+1=2,所以该化合物的化学式为K2NiF4,
故答案为:K2NiF4;
②该晶胞的体积=acm×acm×bcm=a2bcm3,晶胞质量=$\frac{39×4+59×2+19×8}{{N}_{A}}$g=$\frac{426}{{N}_{A}}$g,故晶体密度=$\frac{426}{{N}_{A}}$g÷a2bcm3=$\frac{426}{{N}_{A}{a}^{2}b}$g•cm-3,
故答案为:$\frac{426}{{N}_{A}{a}^{2}b}$;
Ⅱ.(6)取CoCl3•6NH3(黄色)和CoCl3•5NH3(紫红色)两种化合物各1mol,分别溶于水,加入足量硝酸银溶液,产生氯化银沉淀的量分别为3mol和2mol,钻的配位数为6.则CoCl3•6NH3中离子均处于外界,其结构简式为[Co(NH3)6]Cl3 ,在水中的电离方程式为:[Co(NH3)5Cl]Cl2=[Co(NH3)5Cl]2++2Cl-故答案为:[Co(NH3)6]Cl3 ;[Co(NH3)5Cl]Cl2=[Co(NH3)5Cl]2++2Cl-;
(7)铁元素应用广泛,Fe2+与KCN溶液反应得白色Fe(CN)2沉淀,继续滴加KCN至过量,则沉淀溶解,得到黄色溶液,溶液中阴离子结构如图2所示.
①已知CN-与N2结构相似,CN-中C、N原子之间形成C≡N键,1mol CN-中π键数目为2NA,
故答案为:2NA;
②沉淀溶解的化学方程式为:Fe(CN)2+4KCN═K4[Fe(CN)6],
故答案为:Fe(CN)2+4KCN═K4[Fe(CN)6].
点评 本题是对物质结构和性质的考查,正确推断元素是解本题关键,难度中等,注意化学式的确定中各中原子被几个晶胞共用,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 钠和钾的合金可用于快中子反应堆作热交换剂 | |
| B. | 镁与铜、铝等金属形成的合金大量用于制造火箭、飞机、导弹 | |
| C. | 制作印刷电路板时,可用FeCl3溶液腐蚀Cu | |
| D. | 氯气有毒,不能用于药物的合成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L该溶液中含有NaOH 4.0 g | |
| B. | 给NaOH溶液通电,使NaOH发生电离 | |
| C. | NaOH的电离方程式是:NaOH═Na++OH- | |
| D. | NaOH溶液能导电,是因为溶液中有自由移动的Na+、OH-离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
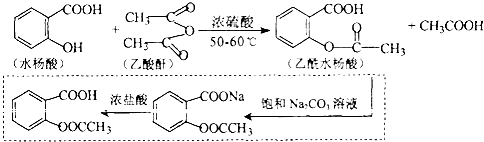


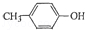 也能与乙酸酐发生类似反应,请写出化学反应方程式,可不写条件:
也能与乙酸酐发生类似反应,请写出化学反应方程式,可不写条件: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制0.1mol/L CuSO4溶液100 mL,需称量CuSO4•5H2O 1.6g | |
| B. | 40g NaOH固体溶于1 L水,所得溶液的浓度为1 mol/L | |
| C. | 200mL 0.2mol/L MgCl2溶液中Cl-的个数为0.08NA | |
| D. | 从100mL 1mol/L H2SO4溶液取出10mL溶液,此溶液的浓度为0.1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 10HCl□
10HCl□查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)+c(HA)=c(OH-) | B. | c(OH-)<c(H+)<c(B+)<c(A-) | ||
| C. | c(H+)+c(B+)<c(A-)+c(OH-) | D. | c(A-)=c(B+)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 剩余固体是铜 | |
| B. | 原固体混合物中铜的质量是9.6g | |
| C. | 反应后溶液中n(Fe3+)=0.10mol | |
| D. | 反应后溶液中n(Fe2+)+n(Cu2+)=0.75mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com