下列说法正确的是(NA代表阿伏加德罗常数)( )
A.把反应:2Fe3++Fe=3Fe2+设计成原电池时,铁作正极
B.已知:25℃时,Mg(OH)2的 Ksp=5.61×10ˉ12,MgF2的Ksp=7.42×10ˉ11,那么,25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)小
C.将含有0.1mol氯化铁的浓溶液滴入到足量的沸水中,能形成0.1NA个氢氧化铁胶体粒子
D.假如有28gFe通过吸氧腐蚀的方式最后变成了铁锈,那么,整个过程中就有0.25NA个氧气分子得到了电子
【答案】
分析:A、依据原电池的工作原理和组成分析,根据电极反应确定正负极;
B、依据沉淀溶解平衡的溶度积比较原则,当物质的阴阳离子比相同时,可以用Ksp大小比较溶解性大小;
C、依据胶体粒子是微粒的结合体分析;
D、依据反应过程中的氧化还原反应的电子守恒计算分析,铁最终为三价铁,氧元素从0价到-2价;
解答:解:A、反应中化合价升高的失去电子发生氧化反应为负极,依据反应化合价变化,铁从0价升高到+2价,发生氧化反应做负极,故A错误;
B、饱和Mg(OH)
2溶液与饱和MgF
2溶液相比阴阳离子的组成比相同,物质的溶解性可以直接用Ksp大小进行比较,题干中氢氧化镁的Ksp小于氟化镁,溶液中的镁离子浓度小于氟化镁,故B正确;
C、0.1mol氯化铁的浓溶液滴入到足量的沸水中,因为胶体粒子是微粒的集合体,氢氧化铁胶体粒子应小于0.1N
A个,故C错误;
D、28gFe物质的量为0.5mol,28gFe通过吸氧腐蚀的方式最后变成了铁锈,根据反应过程中的变化可知铁最终变化为三价铁,氧气得电子变化为-2价氧元素,根据电子守恒得到:
4Fe~2Fe
2O
3~12e
-~3O
2,所以0.5mol铁吸氧腐蚀生锈后,需要氧气物质的量=
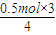
=0.375mol,故D错误;
故选B.
点评:本题考查了原电池的原理应用,电极反应、电极名称的判断,沉淀溶解平衡的应用,胶体离子的组成,金属的吸氧腐蚀过程中的电子守恒的应用.

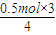 =0.375mol,故D错误;
=0.375mol,故D错误;
