
 连二亚硫酸钠(Na2S2O4),又称保险粉,是印刷工业中重要的还原剂.某课题小组进行如下实验:
连二亚硫酸钠(Na2S2O4),又称保险粉,是印刷工业中重要的还原剂.某课题小组进行如下实验:| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
分析 Ⅱ.(1)根据电子得失守恒和原子守恒书写化学方程式;连二亚硫酸钠是一种白色粉末,易溶于水,难溶于乙醇;
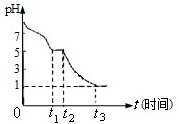
Ⅲ.(1)溶液显酸性,HSO3-的电离程度大于水解程度;Na2S2O4溶液在空气中易被氧化生成亚硫酸氢钠,t3时溶液的pH=1,说明溶液的酸性较强,因此亚硫酸氢钠被氧化为硫酸氢钠;
(2)隔绝空气加热Na2S2O4固体完全分解,得到固体产物Na2SO3、Na2S2O3和气体,其中亚硫酸钠是氧化产物,而Na2S2O3中S是+2价,则根据氧化还原反应中电子得失守恒可知气体应该是SO2.根据反应Na2S2O3+2HCl=2NaCl+S↓+SO2↑+H2O可知要检验硫代硫酸钠.
解答 解:Ⅱ.(1)反应中S元素的化合价从+4价降低到+3价,得到1个电子.甲酸钠中碳元素的化合价从+2价升高到+4价,则根据电子得失守恒和原子守恒可知反应的化学方程式为2HCOONa+Na2CO3+4SO2=2Na2S2O4+3CO2+H2O.连二亚硫酸钠是一种白色粉末,易溶于水,难溶于乙醇,因此可以用乙醇洗涤产品,
故答案为:2HCOONa+Na2CO3+4SO2=2Na2S2O4+3CO2+H2O;乙醇;
Ⅲ.(1)Na2S2O4溶液在空气中易被氧化生成亚硫酸氢钠,则0~t1段发生离子反应方程式为 2S2O42-+O2+2H2O=4HSO3-.0~t1段主要先生成HSO3-,溶液显酸性,HSO3-的电离程度大于水解程度,t3时溶液的pH=1,说明溶液的酸性较强,因此亚硫酸氢钠被氧化为硫酸氢钠,则溶液中主要阴离子符号是SO42-,
故答案为:>;2S2O42-+O2+2H2O=4HSO3-;SO42-;
(2)隔绝空气加热Na2S2O4固体完全分解,得到固体产物Na2SO3、Na2S2O3和气体,其中亚硫酸钠是氧化产物,而Na2S2O3中S是+2价,则根据氧化还原反应中电子得失守恒可知气体应该是SO2.根据反应Na2S2O3+2HCl=2NaCl+S↓+SO2↑+H2O可知要检验硫代硫酸钠,则只需要取少量完全分解的固体产物于试管中,加入稀盐酸,如果有淡黄色沉淀,则有Na2S2O3存在,故答案为:SO2;
| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
| 取少量完全分解的固体产物于试管中,加入稀盐酸 | 若有淡黄色沉淀,则有Na2S2O3存在 |
点评 本题考查氧化还原反应、水解反应、物质制备和检验实验设计与探究,涉及对反应原理、装置及操作的分析评价、离子方程式的书写等,注意对物质性质信息的应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl- | |
| B. | 某溶液中滴加BaCl2溶液,生成白色沉淀,证明一定含有SO42- | |
| C. | 某无色溶液滴入紫色石蕊试液显红色,该溶液一定显碱性 | |
| D. | 某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐或碳酸氢盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c1:c2=1:3 | |
| B. | 当4v(X)正=v(Y)逆时,该反应还在向逆反应方向建立平衡 | |
| C. | X、Y的转化率不相等 | |
| D. | Y起始浓度c2可能为0.36mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
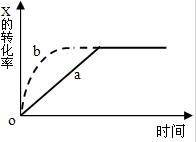 图中曲线a表示放热反应X(g)+Y(g)?Z(g)+N(s)进行过程中X的转化率随时间变化的关系,若只改变一个起始条件,使反应过程按b曲线进行,可采取的措施是( )
图中曲线a表示放热反应X(g)+Y(g)?Z(g)+N(s)进行过程中X的转化率随时间变化的关系,若只改变一个起始条件,使反应过程按b曲线进行,可采取的措施是( )| A. | 升高温度 | B. | 加大X的投入量 | C. | 使用催化剂 | D. | 缩小体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
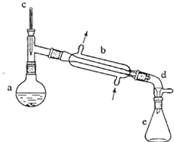 (醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
(醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下: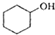 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$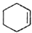 +H2O
+H2O| 相对分子质量 | 密度/(g•cm3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3OH的燃烧热为192.9kJ/mol | |
| B. | 反应①要吸收热量,故反应②更实用些 | |
| C. | CH3OH转变成H2的过程一定要吸收能量 | |
| D. | 根据②推知反应:CH3OH(l)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)的△H>-192.9kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
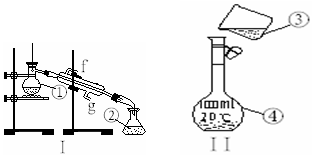 掌握仪器的名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.
掌握仪器的名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
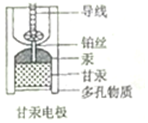 饱和甘汞电极(Hg-Hg2Cl2)因其电动势稳定,常被用作参比电极,其内部构造如图所示,当甘汞电极与锌共同插入ZnCl2溶液中构成原电池时,下列说法正确的是( )
饱和甘汞电极(Hg-Hg2Cl2)因其电动势稳定,常被用作参比电极,其内部构造如图所示,当甘汞电极与锌共同插入ZnCl2溶液中构成原电池时,下列说法正确的是( )| A. | 负极的电极反应式为Zn-2e-═Zn2+ | |
| B. | 正极的电极反应式为Hg2Cl2+2e-═2Hg+2Cl- | |
| C. | 多孔物质相当于盐桥 | |
| D. | 甘汞电极中,Cl-既不是反应物,也不是产物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com