
氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:

已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
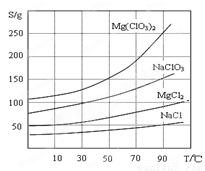
②四种化合物的溶解度(S)随温度(T)变化曲线如图所示。

(1)过滤所需要的主要玻璃仪器有 ,加MgO后过滤所得滤渣的主要成分为 。
(2)加入BaCl2的目的是除去SO42-,如何检验SO42-已沉淀完全?答: 。
(3)加入NaClO3饱和溶液发生反应为:MgCl2+2NaClO3=Mg(ClO3)2+2NaCl↓再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为:① ;② ;③ ;④过滤、洗涤。
(4)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10 mL于锥形瓶中,加入10 mL稀硫酸和20 mL 1.000 mol·L-1的
FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol·L-1 K2Cr2O7 溶液滴定至终点,此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7 溶液15.00 mL。
①写出步骤2中发生反应的离子方程式:
②产品中Mg(ClO3)2·6H2O的质量分数为 。
(1)漏斗、玻璃棒、烧杯 BaSO4和Fe(OH)3
(2)静置,取上层清液加入BaCl2,若无白色沉淀,则SO42-沉淀完全
(3)蒸发结晶 趁热过滤 冷却结晶
(4)①ClO3- +6Fe2++6H+=6Fe3++Cl-+3H2O(2分)
②78.3%(3分)
【解析】
试题分析: (1)加入高锰酸钾将Fe2+氧化为Fe3+,加入氯化钡形成硫酸钡沉淀,加入氧化镁调节pH=4将Fe3+形成氢氧化铁沉淀,过滤所得滤渣为硫酸钡和氢氧化铁,过滤需使用的玻璃仪器有漏斗、烧杯和玻璃棒。(2)静置,向上层清液中继续滴加氯化钡溶液,若无白色沉淀生成,说明SO42-沉淀完全。(3)相同条件下,四种物质中氯化钠溶解度最小,所以加入氯酸钠溶液后,蒸发浓缩,氯化钠析出,趁热过滤,滤液为氯酸镁溶液,将滤液降温结晶得到氯酸镁晶体。(4)ClO3-与Fe2+生成Cl-和Fe3+,离子方程式为ClO3- +6Fe2++6H+=6Fe3++Cl-+3H2O。锥形瓶中过量的Fe2+物质的量为0.009mol,与ClO3-反应的Fe2+为0.011mol,所以Mg(ClO3)2·6H2O物质的量为0.011/12mol,Mg(ClO3)2·6H2O质量分数为0.783。
考点: 化学实验 离子方程式的书写 化学计算


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省新余市高三上学期期末质量检测化学试卷(解析版) 题型:实验题
氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:
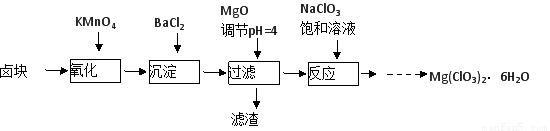
已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S )随温度(T )变化曲线如图所示。
(1)过滤所需要的主要玻璃仪器有??????????? 。
(2)加入BaCl2的目的是???????? ,加MgO后过滤所得滤渣的主要成分为???????????? 。
(3)加入NaClO3饱和溶液后发生反应的化学方程式为?????????????????????????????
(4)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10.00 mL于锥形瓶中,加入10.00 mL稀硫酸和20 .00mL 1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol·L-1 K2Cr2O7? 溶液滴定剩余的Fe2+至终点,此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7??? 溶液15.00 mL。
①写出步骤2中发生反应的离子方程式:???????????????????????????????????????? ;
②产品中Mg(ClO3)2·6H2O的质量分数为?????????? 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市闵行区高三上学期期末教学质量检测化学试卷(解析版) 题型:填空题
氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:
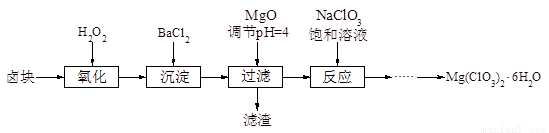
已知:
①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②几种化合物的溶解度(S)随温度(T)变化曲线如图。

(1)加MgO后过滤所得滤渣的主要成分为 。
(2)加入BaCl2的目的是除去SO42-,如何检验SO42-已沉淀完全? 。
(3)加入NaClO3饱和溶液会发生如下反应:
MgCl2+2NaClO3 Mg(ClO3)2+2NaCl↓,
Mg(ClO3)2+2NaCl↓,
请利用该反应,结合右图,制取Mg(ClO3)2·6H2O的实验步骤依次为:
①取样,加入NaClO3饱和溶液充分反应,② ;③ ;④ ;⑤过滤、洗涤,获得Mg(ClO3)2·6H2O晶体。
产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50g产品溶解定容成100mL溶液。
步骤2:取10mL于锥形瓶中,加入10mL稀硫酸和20mL1.000mol/L的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100mol/LK2Cr2O7溶液滴定至终点,此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+ 2Cr3++6Fe3++7H2O。
2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00mL。
(4)上述产品测定中需要检查是否漏液的仪器有 。
步骤3中若滴定前不用标准液润洗滴定管,会导致最终结果偏 。(填“大”或“小”)。
(5)产品中Mg(ClO3)2·6H2O的质量分数为 。(计算结果保留两位小数)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖北省八校高三第一次联考理综化学试卷(解析版) 题型:填空题
氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:

已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S)随温度(T)变化曲线如图所示。

(1)过滤所需要的主要玻璃仪器有 ,
(2)加入BaCl2的目的是 ,加MgO后过滤所得滤渣的主要成分为 。
(3)加入NaClO3饱和溶液后发生反应的化学方程式为 ,再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为:①蒸发结晶;② ;③ ;④过滤、洗涤。
(4)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10.00 mL于锥形瓶中,加入10.00 mL稀硫酸和20 .00mL 1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol·L-1 K2Cr2O7 溶液滴定剩余的Fe2+至终点,此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7 溶液15.00 mL。
①写出步骤2中发生反应的离子方程式: ;
②产品中Mg(ClO3)2·6H2O的质量分数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com