
【题目】某工业含铜废料含有Cu、CuO、CuS、CuSO4等成分,利用该含铜废料可生产硝酸铜晶体[Cu(NO3)2 3H2O],其生产工艺流程如图所示:
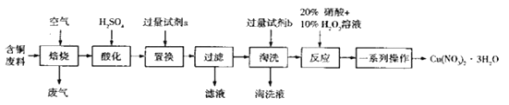
回答下列问题:
(1)“焙烧”过程中生成SO2的化学方程式为___________________。
(2)“酸化”过程的离子方程式为__________________________。
(3)试剂a可以是__________________。
(4)“淘洗”的目的是___________,图中的淘洗液与滤液溶质的阴离子相同,則试剂b是__________,淘洗液的溶质是__________。
(5)“反应”中使用20%硝酸和10% H2O2溶液,硝酸起酸的作用,则“反应”的化学方程式为______________。若该步骤只使用20%硝酸,随着反应的进行,温度升高,出现大量红棕色气体,则生成红棕色气体时反应中还原剂与氧化剂的物质的量之比为___________。
(6)“一系列操作”是指化学实验操作,这些操作需要用到的玻璃仪器有_______________。
【答案】(1)2CuS + 3O2![]() 2SO2 + 2CuO
2SO2 + 2CuO
(2)CuO + 2H+==Cu2++H2O (3) 铁粉、锌粉等
(4)除去过量的试剂a(铁粉、锌粉等) 稀硫酸 H2SO4和FeSO4或H2SO4和ZnSO4
(5)Cu + H2O2 +2HNO3==Cu( NO3)2+2H2O 1:2 (6) 酒精灯、玻璃棒、烧杯、漏斗
【解析】本题考查化学工艺流程,(1)焙烧产生SO2,由CuS与氧气反应,即反应方程式为CuS+O2→CuO+SO2,根据化合价升降法进行配平,即2CuS+3O2 ![]() 2SO2+2CuO;(2)焙烧后得到物质是CuO、CuSO4、Cu,CuO属于酸性氧化物,与硫酸反应的离子方程式为CuO+2H+=Cu2++H2O,Cu不与硫酸反应;(3)加入试剂a,发生置换反应,说明试剂a的金属性强于金属铜,试剂a可以是铁单质,也可以是锌等金属性强于铜的金属;(4)加入试剂a过量,淘洗的目的除去过量的试剂a;根据前面流程,过滤中含有的阴离子是SO42-,由于淘洗液与滤液中阴离子相同,即试剂b中含有SO42-,Cu不与稀硫酸反应,Fe或锌与稀硫酸反应,因此试剂b为稀硫酸;淘洗液中含有的溶质为: H2SO4和FeSO4或H2SO4和ZnSO4 ;(5)淘洗得到物质是Cu,流程制备的是Cu(NO3)2·3H2O,硝酸起酸性,因此铜与H2O2发生氧化还原反应,即Cu+H2O2+HNO3→Cu(NO3)2+H2O,根据化合价升降法进行配平,即Cu+H2O2+2HNO3=Cu(NO3)2+2H2O;产生红棕色气体为NO2 ,此时发生反应Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O,根据反应方程式,HNO3既作氧化剂又起酸性,有2molHNO3作氧化剂,即还原剂与氧化剂物质的量之比为1:2;(6)溶液得到Cu(NO3)2·3H2O,需要进行蒸发浓缩、冷却结晶、过滤、洗涤等,因此需要的玻璃仪器是酒精灯、烧杯、玻璃棒、漏斗。
2SO2+2CuO;(2)焙烧后得到物质是CuO、CuSO4、Cu,CuO属于酸性氧化物,与硫酸反应的离子方程式为CuO+2H+=Cu2++H2O,Cu不与硫酸反应;(3)加入试剂a,发生置换反应,说明试剂a的金属性强于金属铜,试剂a可以是铁单质,也可以是锌等金属性强于铜的金属;(4)加入试剂a过量,淘洗的目的除去过量的试剂a;根据前面流程,过滤中含有的阴离子是SO42-,由于淘洗液与滤液中阴离子相同,即试剂b中含有SO42-,Cu不与稀硫酸反应,Fe或锌与稀硫酸反应,因此试剂b为稀硫酸;淘洗液中含有的溶质为: H2SO4和FeSO4或H2SO4和ZnSO4 ;(5)淘洗得到物质是Cu,流程制备的是Cu(NO3)2·3H2O,硝酸起酸性,因此铜与H2O2发生氧化还原反应,即Cu+H2O2+HNO3→Cu(NO3)2+H2O,根据化合价升降法进行配平,即Cu+H2O2+2HNO3=Cu(NO3)2+2H2O;产生红棕色气体为NO2 ,此时发生反应Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O,根据反应方程式,HNO3既作氧化剂又起酸性,有2molHNO3作氧化剂,即还原剂与氧化剂物质的量之比为1:2;(6)溶液得到Cu(NO3)2·3H2O,需要进行蒸发浓缩、冷却结晶、过滤、洗涤等,因此需要的玻璃仪器是酒精灯、烧杯、玻璃棒、漏斗。


科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.硅元素在自然界里均以化合态存在
B.SiO2不能与水反应生成硅酸,不是酸性氧化物
C.除去二氧化硅中少量的碳酸钙杂质应选用水
D.粗硅制备时,发生的反应为C+SiO2=Si+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物在氧气中充分燃烧,生成的二氧化碳和水的物质的量之比为1 :1,由此可得出的正确结论是( )
A. 该有机物分子中碳、氢、氧原子个数比为1 :2 :3
B. 该有机物分子中碳、氢原子个数比为1 :1
C. 该有机物中肯定含氧
D. 无法判断该有机物中是否含氧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列固体混合物与过量的稀H2SO4反应,能产生气泡并有沉淀生产的是( )
A.NaHCO3和Al(OH)3
B.BaCl2和NaCl
C.KClO3和K2SO4
D.Na2SO3和BaCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质分类是化学研究的重要方法之一。近年来发现,在金星大气层中存在三氧化二碳。下列物质与它属于同类的是
A.SO2、NO B.H2SO4、H2CO3
C.H2、O3 D.Na2SO3、KClO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是( )
A.Na+、K+、OH﹣、Cl﹣
B.Na+、Cu2+、SO42﹣、NO3﹣
C.Mg2+、Na+、SO42﹣、Cl﹣
D.Ba2+、HCO3﹣、NO3﹣、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组在通过反应Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O研究反应速率的影响因素后,对Na2S2O3产生了兴趣,查资料知Na2S2O3的名称为硫代硫酸钠,可视为一个S原子取代了Na2SO4中的一个O原子。该实验小组运用类比学习的思想预测了Na2S2O3的某些性质,并通过实验探究了自己的预测。
【提出假设】
(1)部分学生认为Na2S2O3与Na2SO4结构相似,化学性质也相似,因此室温时Na2S2O3溶液的pH____7(填“>”、“=”或“<”)。
(2)部分学生从S元素化合价推测Na2S2O3与Na2SO4性质相似,均具有较强的____。
【实验探究】取适量Na2S2O3晶体,溶于水中制成Na2S2O3溶液,进行如下探究(填写表中空格)。
实验操作 | 实验现象 | 现象解释(用离子方程式表示) | |
探究① | (3)____ | 溶液pH=8 | (4)____ |
探究② | 向新制氯水(pH<2)中滴加少量Na2S2O3溶液 | 氯水颜色变浅 | (5)____ |
【实验结论】
(6)探究①__________。
(7)探究②__________。
【问题讨论】
(8)甲同学向“探究②”反应后的溶液中滴加硝酸银溶液,观察到有白色沉淀产生,并据此认为氯水可将Na2S2O3氧化。你认为该方案是否正确并说明理由___________。
(9)请你重新设计一个实验方案,证明Na2S2O3被氯水氧化。你的方案是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于以下反应:A(s)+3B(g) ![]() 2C(g)+D(g),在一定温度、压强下,在体积可变的某容器中,当下列物理量不再发生变化时就可确定一定达到平衡状态的是
2C(g)+D(g),在一定温度、压强下,在体积可变的某容器中,当下列物理量不再发生变化时就可确定一定达到平衡状态的是
A. 混合气体的密度不随时间变化而变化 B. 3v正(B)=v逆(D)
C. 混合气体的压强保持不变 D. B、C、D的分子数之比为3:2:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com