
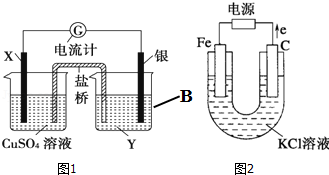
分析 (1)根据反应“2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)”分析,在反应中,Cu被氧化,失电子,应为原电池的负极,电极反应为Cu-2e-=Cu2+,则正极为活泼性较Cu弱的Ag,Ag+在正极上得电子被还原,电极反应为Ag++e=Ag,电解质溶液为AgNO3 ,原电池中,阳离子向正极移动;
(2)图2为电解池,由电子流向正极可知,C为阳极,Fe为阴极,电解氯化钾溶液得到氯气、氢气和氢氧化钾;若图2的电源连接方向开始时就与上述的图示相反,则Fe为阳极,失去电子,阴极氢离子放电生成氢气.
解答 解:(1)①由反应“2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)”可知,在反应中,Cu被氧化,失电子,应为原电池的负极,Ag+在正极上得电子被还原,电解质溶液为AgNO3 ,
故答案为:Cu;AgNO3;
②正极为活泼性较Cu弱的Ag,Ag+在正极上得电子被还原,电极反应为Ag++e=Ag,
故答案为:正极; Ag++e-=Ag;
③原电池中,阳离子向正极移动,即K+向B烧杯移动,故答案为:B;
(2)①图2为电解池,由电子流向正极可知,C为阳极,Fe为阴极,电解氯化钾溶液得到氯气、氢气和氢氧化钾,则电解方程式为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑;
故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑;
②若图2的电源连接方向开始时就与上述的图示相反,则Fe为阳极,失去电子,阴极氢离子放电生成氢气,生成的亚铁离子与氢氧根离子反应生成氢氧化亚铁,观察到产生白色絮状沉淀,
故答案为:产生白色絮状沉淀.
点评 本题考查原电池和电解池,装置的判断是解答的关键,注意把握原电池和电解池的工作原理,明确离子的放电顺序及发生的电极反应即可解答,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 2,3-二甲基丁烷 | B. | 2-甲基-4-乙基-1-己烯 | ||
| C. | 3-甲基-1-丁烯 | D. | 3,3-二甲基-2-戊烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们可能是不同的分子 | B. | 它们可能是不同的离子 | ||
| C. | 它们可能互为同位素 | D. | 它们可能是分子和离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C-H之间只是sp2形成的σ键,C-C之间只是未参加杂化的2p轨道形成的π键 | |
| B. | C-C间是sp2形成的σ键,C-H之间是未参加杂化的2p轨道形成的π键 | |
| C. | sp2杂化轨道形成σ键、未杂化的2p轨道形成π键 | |
| D. | sp2杂化轨道形成π键、未杂化的2p轨道形成σ键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl?NH4++Cl- | B. | H2S?2H++S2- | ||
| C. | K2CO3?2K++CO32- | D. | CH3COONH4=NH4++CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,1 L pH=13的NaOH溶液中,由水电离的OH-数目为0.1NA | |
| B. | 2.0gH218O与D216O的混合物中所含中子数为NA | |
| C. | 50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| D. | 常温常压下,4.4g乙醛所含σ键数目为0.7NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R是第三周期元素 | |
| B. | R元素的最高正价与N元素最高正价相同 | |
| C. | RO3-和NO3-均只能被还原,不能被氧化 | |
| D. | R和N两元素的单质都是空气的主要成分 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO的燃烧热为283 kJ | |
| B. |  如图可表示由CO生成CO2的反应过程和能量关系 | |
| C. | 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H>-452 kJ/mol | |
| D. | CO(g)与Na2O2(s)反应放出509 kJ热量时,生成53gNa2CO3(s) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com