
分析 K+全部由K2SO4溶液提供,根据K+守恒可以求出混合溶液的体积,再根据Al3+守恒求出混合前Al2(SO4)3溶液体积.
解答 解:由K+守恒可知c(K+)×V(K+)=c(K+)混合×V混合,即0.1L×0.1mol•L-1×2=0.1mol•L-1×V混合,解得V混合=0.2L=200mL;
由Al3+守恒可知,c(Al3+、)×V(Al2(SO4)3)=c(Al3+)混合×V混合,即0.2mol•L-1×V(Al2(SO4)3)×2=0.1mol•L-1×0.2L,
解得V(Al2(SO4)3)=0.05L=50mL;
故答案为:50;200.
点评 本题考查了物质的量浓度的计算,题目难度不大,把握好混合前后离子的物质的量相等是解题的关键,注意明确物质的量浓度的概念及表达式.


科目:高中化学 来源: 题型:选择题
| A. | 硒化氢比硫化氢稳定 | |
| B. | 硒与氢气的反应比砷(位于元素周期表中第4周期VA族)与氢气的反应慢 | |
| C. | H2SeO4的酸性比H3AsO4弱 | |
| D. | 硒的原子半径比硫的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
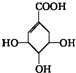 ,关于它的叙述不正确的是( )
,关于它的叙述不正确的是( )| A. | 该有机物能使溴的CCl4溶液褪色 | |
| B. | 该有机物在一定条件下可发生加聚反应,生成高分子化合物(C7H10O5)n | |
| C. | 该有机物在一定条件下可发生氧化反应 | |
| D. | 该有机物发生消去反应可得芳香烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然气 | B. | 液化石油气 | C. | 水煤气 | D. | 氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

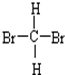 和
和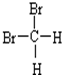
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第1列和第17列元素的单质熔沸点变化趋势相反 | |
| B. | 只有第2列元素原子最外层有2个电子 | |
| C. | 第15列元素的最高价氧化物为R2O58 | |
| D. | 尚未发现的第113号元素在第七周期第13列 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com