
【题目】研究性学习小组的同学们用如图所示装置进行铝热反应的实验,请回答: 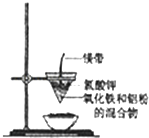
(1)氧化铁与铝反应的化学方程式是 ,
(2)镁带的作用是;氯酸钾的作用是 .
(3)同学们在实验过程中观察到纸漏斗的下部被烧穿,有熔融物落入沙中.他们为探究此熔融物的成分,查阅(化学手册)得知有关物质的熔点、沸点数据如下:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2054 | 1535 | 1462 |
沸点/℃ | 2467 | 2980 | 2750 | ﹣ |
同学们分析数据后推测该熔融物是一种合金,其中的金属是 , 溶解该合金可选用下列试剂中的(填序号).
A.FeSO4溶液 B.稀硫酸 C.稀硝酸 D.NaOH溶液.
【答案】
(1)2Al+Fe2O3 ![]() 2Fe+Al2O3
2Fe+Al2O3
(2)燃烧时提供热量,引发反应;受热分解提供氧气,帮助镁条燃烧
(3)Al、Fe;BC
【解析】解:(1)高温下,金属铝能够与氧化铁反应置换出铁,反应的化学方程式为:Fe2O3+2Al ![]() 2Fe+Al2O3 , 所以答案是:2Al+Fe2O3
2Fe+Al2O3 , 所以答案是:2Al+Fe2O3 ![]() 2Fe+Al2O3;(2)镁在空气中剧烈燃烧,放出大量热,镁条在铝热反应中提供热量,起到引燃剂的作用,氯酸钾受热分解生成氧气起助燃的作用;所以答案是:燃烧时提供热量,引发反应;受热分解提供氧气,帮助镁条燃烧;(3)根据表中的数据可以看出,金属铝的熔点点比铁低,当金属铁是液态时,金属铝也是液态,所以铝热反应得到的是金属铁和金属铝的混合物;硫酸亚铁、氢氧化钠溶液不与铁反应,所以既能和金属铁反应又能和金属铝反应的物质为稀硫酸,稀硝酸,故BC正确,所以答案是:Al、Fe; BC.
2Fe+Al2O3;(2)镁在空气中剧烈燃烧,放出大量热,镁条在铝热反应中提供热量,起到引燃剂的作用,氯酸钾受热分解生成氧气起助燃的作用;所以答案是:燃烧时提供热量,引发反应;受热分解提供氧气,帮助镁条燃烧;(3)根据表中的数据可以看出,金属铝的熔点点比铁低,当金属铁是液态时,金属铝也是液态,所以铝热反应得到的是金属铁和金属铝的混合物;硫酸亚铁、氢氧化钠溶液不与铁反应,所以既能和金属铁反应又能和金属铝反应的物质为稀硫酸,稀硝酸,故BC正确,所以答案是:Al、Fe; BC.


科目:高中化学 来源: 题型:
【题目】苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是C8H10(g)C8H8(g)+H2(g)△H>0 Ⅰ.某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内物质的量,得到数据如下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2[来源:] | n3 |
n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
(1)当反应进行到20min时,该段时间内H2的平均反应速率是 .
(2)该温度下,该反应的化学平衡常数是 .
化学键 | C﹣H | C﹣C | C=C | H﹣H |
键能/kJmol1 | 412.5 | 348 | 612 | 436 |
(3)已知: 计算上述反应的△H=kJmol﹣1 . 若保持其他条件不变,用0.40mol H2(g)和0.40mol C8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是 . 此时,该反应是否达到了平衡状态?(填“是”或“否”).
Ⅱ.工业上以高温水蒸气作为反应体系的稀释剂(不参与反应),C8H10(g)的平衡转化率与水蒸气的用量、体系的温度、压强的关系如图Ⅰ、图Ⅱ所示.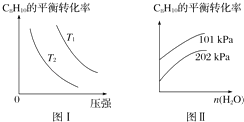
(4)由图Ⅰ可知,T1T2(填“大于”、“小于”或“等于”).
(5)由图Ⅱ可知,当其他条件不变时,水蒸气的用量越大,C8H10的平衡转化率将(填“越大”、“越小”或“不变”),原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
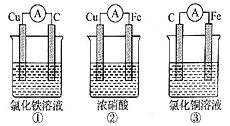
【题目】(1)为了验证Fe2+与Cu2+氧化性强弱,下列装置能达到实验目的的是______,写出正极的电极反应_______。若构建原电池时两个电极的质量相等,当导线中通过0.05mol电子时,两个电极的质量差为________。
(2)将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。
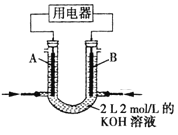
①实验测得OH-定问移向B电极,则_____处电极入口通甲烷(填A或B),其电极反应式为___________。
②当消耗甲院的体积为33.6L(标准状况下)时,假设电池的能量转化率为80%,则导线中转移电子的物质的量为________。
(3)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应式为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,原电池负极的电极反应式为__________;放电时每转移3mol电子,有_____mol K2FeO4被还原,正极附近溶液的碱性________(填“增强”。“不变“或“减弱”)。
3Zn(OH)2+2Fe(OH)3+4KOH,原电池负极的电极反应式为__________;放电时每转移3mol电子,有_____mol K2FeO4被还原,正极附近溶液的碱性________(填“增强”。“不变“或“减弱”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种化合物W,X,Y,Z,它们都是由短周期元素A,B,C,D,E中的两种元素组成的.已知: (a)A,B,C,D,E五种元素的原子序数依次增大,且A,D同主族,C,E同主族,B、C同周期.
(b)W由B,C组成,分子中原子个数比为B:C=1:2,固体易升华.
(c)X由A,C组成,分子中原子个数比为A:C=1:1.
(d)Y由C,D形成的离子化合物,且Y中相应元素的微粒之比为:C:D=1:1.
(e)Z是由D,E形成的离子化合物,其中阳离子比阴离子少一个电子层,阴、阳离子数之比为1:2.
试回答下列各小题:
(1)各元素符号:ABCDE
(2)W的电子式: .
(3)X的结构式: .
(4)Y的电子式: .
(5)Z的化学式: .
(6)写出Y与水反应的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为与水相关的部分转化关系(水作反应物或生成物,部分产物和反应条件未列出).下列说法错误的是( ) 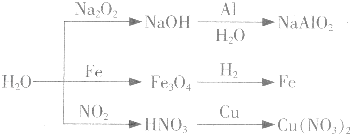
A.如图所示的反应均为氧化还原反应
B.比较镁、铁与水的反应条件,可知铁的金属性比镁弱
C.工业上常用NO2与水的反应原理制取硝酸
D.实验室中可用铜与稀硝酸反应制取NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质能通过化合反应直接制得的是( )
①FeCl2②H2SO4③NH4NO3④HCl ⑤FeCl3 .
A.只有①②③
B.只有④⑤
C.只有①③④
D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯碱是工业生产和日常生活中的重要物质.某兴趣小组为测定某工业纯碱(假设仅含碳酸氢钠杂质)中碳酸钠的质量分数,设计了下列四种实验方案进行探究.请填空: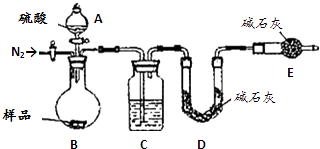
方案一:纯碱样品 ![]() 测定剩余固体质量
测定剩余固体质量
(1)分别称取干燥坩埚和纯碱样品的质量,将纯碱样品放入坩埚中充分加热.坩埚中发生反应的化学方程式为: .
(2)将坩埚置于干燥器中冷却后称量.实验时需要重复“加热、冷却、称量”操作多次,其目的是: . 方案二:称取mg样品配成250mL溶液,从中取25mL溶液先用酚酞作指示剂用0.1molL﹣1HCl溶液滴定至终点,消耗0.1molL﹣1HCl溶液V1mL,继续用甲基橙作指示剂滴定至终点,消耗0.1molL﹣1HCl溶液V2mL.则该样品中碳酸钠的质量分数为: .
方案三:纯碱样品溶液 ![]() 测定沉淀质量
测定沉淀质量
(3)称取m1g样品,置于小烧杯中,加水溶解.向小烧杯中滴加足量氯化钙溶液.将反应混和物过滤后的下一步操作是: , 沉淀经干燥后称量为m2g.
(4)如果用氢氧化钙溶液代替氯化钙溶液作沉淀剂,在其他操作正确的情况下,测得样品中的碳酸钠质量分数将比实际(填“偏高”、“偏低”或“不变”).方案四:纯碱样品 ![]() 测定生成二氧化碳的质量
测定生成二氧化碳的质量
(5)本实验采用如下图装置,C中盛放的物质是 .
(6)反应前后都要通入N2 , 反应后通入N2的目的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡酸苯乙酯是一种天然抗癌药物,在一定条件下能发生如下转化.
咖啡酸苯乙酯结构: 
请回答下列问题:
(1)A分子中的含氧官能团是
(2)D→E的反应类型为
(3)写出C的结构简式
(4)下列说法中正确的是
A.经除杂后得到的M是纯净物
B.上述流程中A,B,C,D均能使酸性高锰酸钾褪色
C.咖啡酸苯乙酯与足量的氢氧化钠溶液反应最多消耗NaOH的物质的量为3mol
D.物质A能发生的反应类型包括加成反应,取代反应,氧化反应,还原反应
(5)物质N是A的一种同分异构体,任意写出一种满足下列条件的N的结构简式①苯环上只有两个取代基 ②能发生银镜反应
③能与碳酸氢钠溶液反应 ④能与氯化铁溶液发生显色反应
(6)写出生成B的化学方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com