
| A. | 棉布、羊毛和涤纶燃烧后都只生成二氧化碳和水 | |
| B. | 乙酸乙酯和食用植物油均可水解生成乙醇 | |
| C. | 氢氧化铝、氢氧化钠、碳酸钠都是常见的胃酸中和剂 | |
| D. | 生物柴油和石化柴油相比,使用生物柴油环保,可以减少SO2的排放,且生物柴油属于可再生能源 |
科目:高中化学 来源: 题型:解答题
 某研究性学习小组,为了探究过氧化钠的强氧化性,设计了如图的实验装置.
某研究性学习小组,为了探究过氧化钠的强氧化性,设计了如图的实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
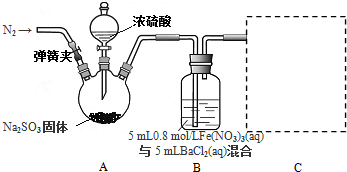
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 实验现象 | 结论或推论 | |
| A | 溴水中加入甲苯,振荡 | 水层几乎呈无色 | 甲苯与溴发生了反应 |
| B | 一小粒金属钠投入无水乙醇中 | 最后钠浮在液面上 | 密度:乙醇大于钠 |
| C | Fe(SCN)3溶液中滴入足量NaOH溶液 | 澄清后得到无色溶液 | Fe(OH)3悬浊液中滴加KSCN溶液后不显红色 |
| D | 在含Mn2+的草酸溶液中滴加酸性高锰酸钾溶液 | 高锰酸钾溶液褪色较快 | 反应过程中,Mn2+一定氧化了草酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
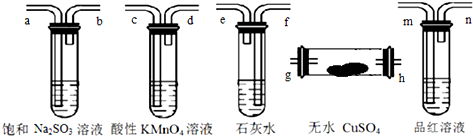
| A. | h-g-m-n-a-b-f-e-c-d | B. | g-h-m-n-a-b-e-f-c-d | ||
| C. | h-g-c-d-m-n-f-e-a-b | D. | h-g-m-n-c-d-e-f-a-b |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
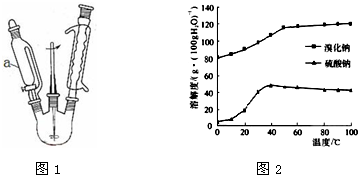
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30 g乙烷中所含的极性共价键数为7NA | |
| B. | 常温常压下,28g乙烯与丁烯的混合气体含有的碳原子数目NA | |
| C. | 密闭容器中2molNO与1molO2充分反应,产物的分子数小于2NA | |
| D. | 标准状况下,22.4L HF含有的分子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某芳香烃的分子式为C10H14,它不能使溴水褪色,但可使酸性KMnO4溶液褪色,且分子结构中只有一个烷基,符合条件的烃有3种 | |
| B. | 常压下,正戊烷、异戊烷、新戊烷的沸点依次降低 | |
| C. | 肌醇 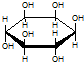 与葡萄糖 与葡萄糖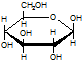 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 | |
| D. | 1.0 mol的有机物(结构如图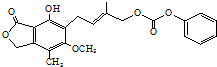 )最多能与含5.0 mol NaOH的水溶液完全反应 )最多能与含5.0 mol NaOH的水溶液完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四氯化碳分子的比例模型: | |
| B. | 羟基可以表示为:-OH 或 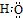 | |
| C. | 氯离子(Cl-)的结构示意图: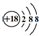 | |
| D. | NaHSO4熔融时的电离方程式:NaHSO4=Na++H++SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com