
某学生在0.1 mol/L NaHCO3溶液中滴加酚酞溶液1滴,整个溶液几乎没有什么变化,但溶液加热后,显明显淡红色,加热较长时间后冷却,红色不褪去.
该学生为了了解该过程的原因,进行了下列探究过程:
[实验探究]
实验1:加热0.1 mol/LNaHCO3溶液,测得溶液pH变化如下表
实验2:10℃时,在烧杯中加入0.1 mol/L NaHCO3溶液200 mL,测得该溶液pH=8.3,加热到100℃,测得pH=10.2,恢复到10℃,pH=9.8.
实验3:加热0.1 mol/L NaHCO3溶液,将产生的气体通入澄清石灰水,溶液变浑浊.
实验4:
①配制0.1 mol/L NaHCO3溶液和0.1 mol/L Na2CO3溶液各200 mL,10℃时,分别测得NaHCO3溶液pH=8.3,Na2CO3溶液pH=11.5.
②加热蒸发0.1 mol/L NaHCO3溶液200 mL,至溶液体积100 mL,停止加热,加水至200 mL,冷却至原温度,测得溶液pH=9.8.
③将0.1 mol/L NaHCO3溶液200 mL敞口放置三天,再加水至200 mL,测得溶液pH=10.1.
请根据上述实验回答下列问题:
1.用离子方程式表示0.1 mol/LNaHCO3溶液中存在的平衡(除水电离平衡外)________、________.这两个平衡以________为主,理由是________.
2.实验3得到的结论是________.
3.结合实验2、3分析,加热0.1 mol/LNaHCO3溶液,pH增大的原因可能是________、________、________.
4.实验4①得到的结论是________.
5.实验4②“加水至200 mL”的目的是________.
实验4③可以得到的结论是________.
6.要确定NaHCO3溶液加热后pH增大的主要原因还需要解决的问题是________.
科目:高中化学 来源:安徽省省城名校2012届高三第三次联考试题化学试题 题型:058
Ⅰ.如图所示,50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L,NaOH溶液在装置中进行中和反应.通过测定反应过程中所放出的热量,可计算中和热,回答下列问题:
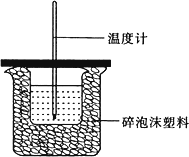
(1)图中装置缺少的仪器是________.
(2)下列说法中不正确的是________.(填字母,下同)
A.若用50 mL 0.55 mol·L-1的Ba(OH)2溶液代替NaOH溶液进行实验,测得的中和热是相同的
B.若用50 mL 0.50 mol·L-1的醋酸溶液代替盐酸进行实验,测得的中和热是相同的
C.若分别用等浓度的硫酸和Ba(OH)2溶液代替盐酸和NaOH溶液进行实验,测得的中和热是相同的
D.NaOH溶液稍过量的原因是让盐酸完全反应
Ⅱ.某学生用0.1 mol·L-1的盐酸标准溶液滴定未知浓度的20.00 mL氨水,用酚酞做指示剂,回答下列问题:
(1)在滴定时,左手握________(填仪器名称)的活塞,右手摇动锥形瓶,眼睛注视________.直到最后加入一滴盐酸后,溶液出现________现象,说明达到滴定终点,记录数据,发现消耗盐酸25.00 mL.
(2)下列操作中可能使所测氨水溶液的浓度数值偏低的是________.
A.酸式滴定管未用标准盐酸润洗,就直接注入标准盐酸
B.滴定前盛放氨水的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)当盐酸与氨水恰好完全反应生成盐时,消耗的盐酸溶液体积V________(填“>”、“<”或“=”)25.00 mL.
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生用0.1 mol·L-1的KOH标准溶液滴定未知浓度的盐酸,其操作分解为如下几步:
A.移取20 mL待测盐酸注入洁净的锥形瓶,并加入2~3滴酚酞
B.用标准溶液润洗滴定管2~3次
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准KOH溶液注入碱式滴定管至“0”刻度以上1~2 cm
E.调节液面至“0”或“0”以下刻度,记下读数
F.在锥形瓶下垫一张白纸,把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)___________________________________;
(2)操作中锥形瓶下垫一张白纸的作用是___________________________________________;
(3)判断到达滴定终点的实验现象是_________________________________ ____;
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省南安一中高二下学期期中考试化学试卷(带解析) 题型:实验题
某学生用0.1 mol·L-1的KOH标准溶液滴定未知浓度的盐酸,其操作分解为如下几步:
| A.移取20 mL待测盐酸注入洁净的锥形瓶,并加入2~3滴酚酞 |
| B.用标准溶液润洗滴定管2~3次 |
| C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液 |
| D.取标准KOH溶液注入碱式滴定管至“0”刻度以上1~2 cm |
查看答案和解析>>
科目:高中化学 来源:2013届福建省高二下学期期中考试化学试卷(解析版) 题型:实验题
某学生用0.1 mol·L-1的KOH标准溶液滴定未知浓度的盐酸,其操作分解为如下几步:
A.移取20 mL待测盐酸注入洁净的锥形瓶,并加入2~3滴酚酞
B.用标准溶液润洗滴定管2~3次
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准KOH溶液注入碱式滴定管至“0”刻度以上1~2 cm
E.调节液面至“0”或“0”以下刻度,记下读数
F.在锥形瓶下垫一张白纸,把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)_____________________________ ______;
(2)操作中锥形瓶下垫一张白纸的作用是___________________________________________;
(3)判断到达滴定终点的实验现象是_________________________________ ____;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com