
下列四种盐酸溶液,均能跟锌片反应,其中最初反应速率最快的是
| A.10℃ 20mL 3mol/L的盐酸溶液 | B.20℃ 30mL 2mol/L的盐酸溶液 |
| C.20℃ 20mL 2mol/L的盐酸溶液 | D.20℃ 10mL 4mol/L的盐酸溶液 |
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:单选题
为减小CO2对环境的影响,在倡导“低碳”的同时,还需加强对CO2创新利用的研究。T10C 时,将9molCO2和12molH2充入3L密闭容器中,发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH<0,容器中CH3OH的物质的量随时间变化如曲线I所示,平衡时容器内压强为P。改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线II所示。下列说法错误的是
CH3OH(g)+H2O(g) ΔH<0,容器中CH3OH的物质的量随时间变化如曲线I所示,平衡时容器内压强为P。改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线II所示。下列说法错误的是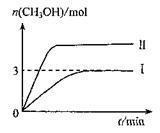
| A.曲线II对应的条件改变是增大压强 |
| B.T2°C时,上述反应平衡常数为0.42,则T2> T1 |
| C.在T10C,若起始时向容器中充入5 mol CO2、5 mol H2、5 mol CH3OH(g)和5 mol H2O(g),则达平衡前v(正)>v(逆) |
D.在T10C,若起始时向容器由通入4,5 molCO2、6mol H2 ,平衡时容器内压强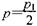 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
关于下列四个说法正确的是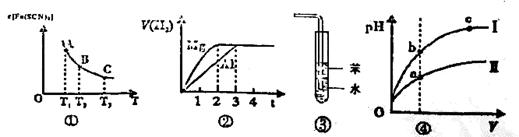
| A.已知图①是体系Fe3++3SCN-=Fe(SCN)3中c[Fe(SCN)3]与温度T的平衡图像,则A点与B点相比,A点的Fe3+浓度大 |
| B.图②表示镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积V(H2) 与时间t的关系。则反应中镁和铝的反应速率之比为2 : 3 |
| C.图③可用于吸收HCl气体,并防倒吸 |
| D.图④是某温度下,相同体积,相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积V变化的曲线。II为醋酸稀释时pH的变化曲线 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在25℃时,密闭容器中X、Y、Z三种气体的浓度变化情况如图: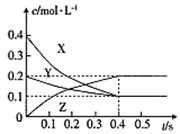
下列说法错误的是( )
A.反应可表示为3X+Y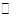 2Z 2Z |
| B.从反应开始到0.4s时,以Y表示的化学反应速率为:0.25mol·L-1·s-1 |
| C.增大压强使平衡向生成Z的方向移动,平衡常数增大 |
| D.升高温度,平衡常数可能增大也可能减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列措施中,能减慢化学反应速率的是
| A.食物储存在冰箱里 |
| B.将块状固体药品研细后再反应 |
| C.用MnO2作H2O2分解反应的催化剂 |
| D.用30%H2SO4溶液代替5%H2SO4溶液与锌粒反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
工业制硫酸中的一步重要反应是SO2在400~500℃下的催化氧化:2SO2+O2 2SO3,这是一个放热的可逆反应。如果反应在密闭容器中进行,下列有关说法中,错误的是
2SO3,这是一个放热的可逆反应。如果反应在密闭容器中进行,下列有关说法中,错误的是
| A.使用催化剂是为了加快反应速率,提高生产效率 |
| B.在上述条件下,SO2不可能100%地转化为SO3 |
| C.达到平衡时,改变反应条件可能在一定程度上改变该反应的化学平衡状态 |
| D.达到平衡时,SO2的浓度与SO3的浓度一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将H2(g)和Br2(g)充入恒容密闭容器中,恒温下发生反应H2(g)+Br2(g)  2HBr(g) (正反应放热),平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。 a与b的关系是
2HBr(g) (正反应放热),平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。 a与b的关系是
| A.a>b | B.a =b | C.a <b | D.无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在一个体积固定的密闭容器中,进行可逆反应A(s)+3B(g) 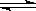 3C (g) 。下列叙述中表明该可逆反应一定达到平衡状态的是
3C (g) 。下列叙述中表明该可逆反应一定达到平衡状态的是
①C的生成速率与C的分解速率相等;②单位时间内生成amol A,同时生成3amol B;
③B的浓度不再变化; ④混合气体总的物质的量不再发生变化;
⑤A、B、C的物质的量之比为1:3:3; ⑥混合气体的密度不再变化;
A.①③⑥ B.①③④⑥ C.①②③ D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
100mL 6 mol / L H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的
| A.硫酸钾溶液 | B.醋酸 | C.氯化钠(固体) | D.盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com