
【题目】写出下列盐类水解的离子方程式:
(1)NH4Cl::________________________________
(2)CH3COONa: ________________________________
(3)FeCl3:________________________________
(4)Na2CO3:________________________________、________________________________
(5)NaHCO3:________________________________
【答案】NH4++H2O ![]() NH3H2O + H+ CH3COO- + H2O
NH3H2O + H+ CH3COO- + H2O![]() CH3COOH + OH- Fe3+ +3H2O
CH3COOH + OH- Fe3+ +3H2O ![]() Fe (OH)3 + 3H+ CO32-+H2O
Fe (OH)3 + 3H+ CO32-+H2O ![]() HCO3- +OH- HCO3- + H2O
HCO3- +OH- HCO3- + H2O ![]() H2CO3 +OH- HCO3- + H2O
H2CO3 +OH- HCO3- + H2O ![]() H2CO3 +OH-
H2CO3 +OH-
【解析】
根据盐类水解规律进行分析,强酸弱碱盐水解显酸性;强碱弱酸盐水解显碱性;多元弱酸形成的盐分步水解,以第一步为主;
(1)NH4Cl为强酸弱碱盐,水解显酸性,铵根离子水解生成一水合氨和氢离子,离子方程式:NH4++H2O ![]() NH3H2O + H+;
NH3H2O + H+;
因此,本题答案是:NH4++H2O ![]() NH3H2O + H+。
NH3H2O + H+。
(2)CH3COONa为强碱弱酸盐,水解显碱性,醋酸根离子水解生成醋酸和氢氧根离子,离子方程式:CH3COO- + H2O![]() CH3COOH + OH- ;
CH3COOH + OH- ;
因此,本题答案是:CH3COO- + H2O![]() CH3COOH + OH- 。
CH3COOH + OH- 。
(3)FeCl3为强酸弱碱盐,水解显酸性,铁离子水解生成氢氧化铁和氢离子,离子方程式:Fe3+ +3H2O ![]() Fe (OH)3 + 3H+ ;
Fe (OH)3 + 3H+ ;
因此,本题答案是:Fe3+ +3H2O ![]() Fe (OH)3 + 3H+ 。
Fe (OH)3 + 3H+ 。
(4)Na2CO3为强碱弱酸盐,水解显碱性,碳酸根离子水解生成碳酸氢根离子和氢氧根离子,碳酸氢根离子接着水解产生碳酸分子和氢氧根离子,离子方程式:CO32-+H2O ![]() HCO3- +OH- ; HCO3- + H2O
HCO3- +OH- ; HCO3- + H2O ![]() H2CO3 +OH-。
H2CO3 +OH-。
因此,本题答案是:CO32-+H2O ![]() HCO3- +OH- ; HCO3- + H2O
HCO3- +OH- ; HCO3- + H2O H2CO3 +OH-。
(5)NaHCO3 为强碱弱酸盐,HCO3-既能发生水解又能发生电离,最终水解大于电离,溶液显碱性,离子方程式:HCO3- + H2O![]() H2CO3 +OH-。
H2CO3 +OH-。
因此,本题答案是:HCO3- + H2O![]() H2CO3 +OH-。
H2CO3 +OH-。


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
【题目】标准状况下有①6.72L甲烷②3.01×1023个氯化氢分子③13.6 g硫化氢④0.2 mol NH3。下列对这四种气体的关系从小到大表示不正确的是
A.体积:④<①<②<③B.密度:①<④<③<②
C.质量:④<①<③<②D.氢原子数:②<④<③<①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据物质结构有关性质和特点,回答下列问题:
(1)Ti基态原子核外价电子排布式为____________,基态镁原子核外电子有____________种不同的空间运动状态。
(2)钛存在两种同素异形体,α—Ti采纳六方最密堆积,β—Ti采纳体心立方堆积,由α—Ti转变为β—Ti晶体体积____________(填“膨胀”或“收缩”)。
(3)写出与NH4+互为等电子体的一种分子和一种离子的化学式____________、____________。
(4)丙烯腈(CH2=CH-CN)分子中![]() 键和π键的个数比为____________,分子中碳原子轨道杂化类型是____________。
键和π键的个数比为____________,分子中碳原子轨道杂化类型是____________。
(5)请写出H、C、N、O元素电负性由大到小的顺序____________。
(6)金属Na的熔点、沸点都比金属Mg低的原因是________________________。
(7)Cu与O元素形成的某种化合物的晶胞结构如图所示,晶胞中氧原子的配位数为___________,若阿伏加德罗常数值为NA,晶胞的边长为apm,该晶体的密度为___________g·cm-3.

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于平衡常数K的说法中,正确的是
A. 在任何条件下,化学平衡常数是一个恒定值
B. 平衡常数K只与温度有关,与反应浓度、压强无关
C. 平衡常数K不仅与温度有关,也与反应浓度、压强有关
D. 对于可逆反应C(s)+H2O(g) ![]() CO(g)+H2(g),在一定温度下达到平衡时,其平衡常数表达式为
CO(g)+H2(g),在一定温度下达到平衡时,其平衡常数表达式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2作为一种广谱型的消毒剂,将逐渐用来取代Cl2成为自来水的消毒剂。已知ClO2是一种易溶于水而难溶于有机溶剂的气体,如图是实验室用于制备和收集一定量较纯净的ClO2的装置(某些夹持装置和垫持用品省略)。其中E中盛有CCl4液体(用于除去ClO2中的未反应的Cl2)。
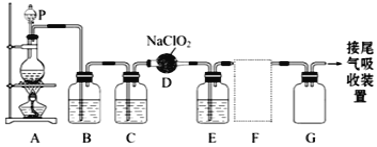
(1)仪器P的名称是___。
(2)实验室制备ClO2的原理是用亚氯酸钠固体与氯气反应,写出D中发生反应的方程式:___。
(3)B装置中所盛的试剂是___。
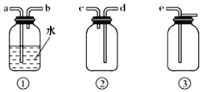
(4)F为ClO2收集装置,应选用的装置是___(填序号),其中与E装置导管相连的导管口是___(填接口字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】马来酸酐(顺-丁烯二酸酐)![]() 是一种重要的化工原料,可用于合成可降解的高聚物PES树脂以及具有抗肿瘤活性的化合物K。
是一种重要的化工原料,可用于合成可降解的高聚物PES树脂以及具有抗肿瘤活性的化合物K。

已知:①![]()
②
③![]() (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)
回答下列问题:
(1)C的名称是________,反应②的反应类型是___________。
(2)B的顺式结构简式为_________,F的结构简式为__________。
(3)反应①的化学方程式为_________。
(4)C有多种同分异构体,其中与C具有完全相同的官能团,且核磁共振氢谱只有两个峰的同分异构体的结构简式为______(不考虑立体异构)。
(5)已知:氨基(-NH2)与羟基类似,也能发生反应①。在由F制备K的过程中,常会产生副产物L。L分子式为C16H13NO3,含三个六元环,则L的结构简式为______。
(6)已知:酸酐在水溶液中极易水解。写出由马来酸酐![]() 合成酒石酸
合成酒石酸![]() 的合成路线:____________________。
的合成路线:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列图像描述正确的是

A. 图①可表示将氨气通入醋酸溶液至过量过程中溶液导电性的变化
B. 根据图②可判断可逆反应A2(g)+3B2(g)![]() 2AB3(g)的ΔH>0
2AB3(g)的ΔH>0
C. 图③表示等体积、等pH的盐酸与醋酸溶液分别与足量的锌粉发生反应产生氢气的体积(V)随时的变化的示意图
D. 图④可表示压强对可逆反应A(g)+B(g)![]() 2C(g)+D(g)的影响,乙的压强大
2C(g)+D(g)的影响,乙的压强大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语正确的是
A. HClO电离 HClO=ClO-+H+
B. CuSO4水解 Cu2++2H2O![]() Cu(OH)2↓+2H+
Cu(OH)2↓+2H+
C. NaHCO3电离 NaHCO3![]() Na++HCO3-
Na++HCO3-
D. KF水解 Fˉ+H2O![]() HF+OHˉ
HF+OHˉ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某厂废酸主要含硫酸、Fe3+、Fe2+、TiO2+、Al3+ 。利用该废液制备过二硫酸铵[( NH4) 2S2O8]和TiO2的一种工艺流程如下:

已知:i.TiOSO4在热水中易水解生成H2TiO3,相关离子形成氢氧化物沉淀的pH范围如 下表:
金属离子 | TiO2+ | Fe3+ | Fe2+ | Al3+ |
开始沉淀的pH | 1.2 | 1.9 | 7.0 | 3.2 |
沉淀完全的pH | 2.8 | 3.1 | 9.4 | 4.7 |
ii. pH>7 时,Fe2+部分生成 Fe( Ⅱ)氨络离Fe(NH3)2]2+o
请回答下列问题:
(1)加入适量Fe的作用是________________ .
(2)生成TiO(OH)2的化学方程式为_______________ 。
(3)滤渣I、滤渣II均含有的物质的化学式为_____________ .
(4)加入H2O2的目的是除掉Fe( Ⅱ)氨络离子[Fe(NH3)2]2+,此过程中氧化剂与还原剂的物质的量之比理论上等于________ (填数值)。
(5)常温下,含硫微粒主要存在形式与pH的关系如下图所示。

用Pt电极电解饱和NH4HSO4溶液制备过二硫酸铵时,为满足在阳极放电的离子主要为 HSO4-,应调节阳极区溶液的pH范围在______之间,其电极反应式为____________ 。
(6)科研人员常用硫酸铁铵[NH4Fe(SO4)2]滴定法测定TiO2的纯度,其步骤为: 用足量酸溶解wg 二氧化钛样品,用铝粉做还原剂,过滤、洗涤,将滤液定容为100 mL,取 25.00 mL,以NH4SCN作指示剂,用标准硫酸铁铵溶液滴定至终点,反应原理为: Ti3++Fe3+=Ti4++Fe2+。
①判断滴定终点的方法:________________________ 。
②滴定终点时消耗c mol/L-1 NH4Fe(SO4)2溶液VmL,则TiO2纯度为___________(写岀相关字母表示的代数式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com