
分析 (1)Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,利用等量代换列式计算出生成硫酸铜的物质的量;
(2)根据c=$\frac{n}{V}$计算出所得硫酸铜溶液的物质的量浓度.
解答 解:(1)Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4 +SO2↑+2H2O
1mol 22.4L
n(CuSO4) 3.36L
则:n(CuSO4)=$\frac{1mol×3.36L}{22.4L}$=0.15mol,
答:反应生成硫酸铜的物质的量为0.15mol;
(2)将生成的硫酸铜配制成500mL溶液,则该溶液中溶质的物质的量浓度为:c(CuSO4)=$\frac{0.15mol}{0.5L}$=0.3mol•L-1,
答:该溶液中溶质的物质的量浓度是0.3mol•L-1.
点评 本题考查了化学方程式的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握等量代换法在化学计算中的应用,试题培养了学生的化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
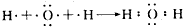 .
.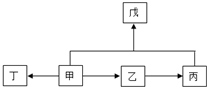 (3)A、B、C三种元素能形成多种化合物.某化合物甲一分子中含有一个氧原子,相对分子质量为46,其存在如图转化关系:
(3)A、B、C三种元素能形成多种化合物.某化合物甲一分子中含有一个氧原子,相对分子质量为46,其存在如图转化关系: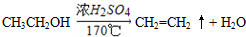 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
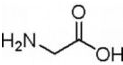
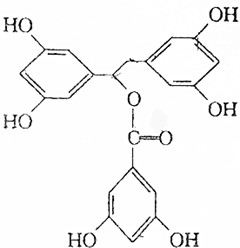 某有机物K的结构简式如图:等物质的量的K分别与足量的氢氧化钠溶液、足量氢气(镍、加热)、足量的溴水反应,消耗NaOH、H2、Br2的物质的量之比为( )
某有机物K的结构简式如图:等物质的量的K分别与足量的氢氧化钠溶液、足量氢气(镍、加热)、足量的溴水反应,消耗NaOH、H2、Br2的物质的量之比为( )| A. | 7:9:9 | B. | 8:9:9 | C. | 7:10:9 | D. | 7:9:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) | |
| B. | 常温下,pH=2的CH3COOH溶液和H2SO4溶液、pH=12的氨水和NaOH溶液,四种溶液中由水电离出的c(H+)不相等 | |
| C. | 常温下将浓度为0.1 mol•L-1的HF溶液加水不断稀释,溶液中$\frac{c({H}^{+})}{c(HF)}$的值始终保持增大 | |
| D. | 常温下0.1 mol•L-1的下列溶液①NH4Fe(SO4)2 ②NH4Cl ③NH3•H2O ④CH3COONH4中,c(NH4+)由大到小的顺序是:②>①>④>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | X的基态原子L层电子数是K层电子数的2倍 |
| Y | Y的基态原子最外层电子排布式为:nsnnpn+2 |
| Z | Z存在质量数为23,中子数为12的核素 |
| W | W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
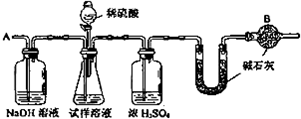
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com