
| A、2 | B、3 | C、4 | D、5 |
科目:高中化学 来源: 题型:
| A、将城市的大型电镀工厂改建在农村,既促进农村经济发展又减轻城市用水污染 | ||||
| B、可吸入颗粒(例如硅酸盐粉尘)形成气溶胶,对人类健康危害极大 | ||||
| C、核裂变是一种化学变化 | ||||
D、核电站泄露的
|
查看答案和解析>>
科目:高中化学 来源: 题型:
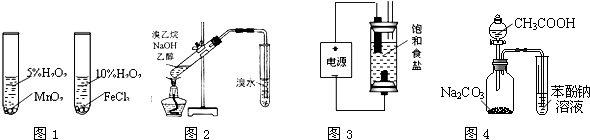
| A、用图1装置验证比较不同催化剂对反应速率的影响 |
| B、用图2所示装置检验溴乙烷与NaOH醇溶液共热产生的乙烯 |
| C、用图3装置制备少量含NaClO的消毒液 |
| D、利用图4装置证明酸性:CH3COOH>H2CO3>苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(D)=0.4 mol?L-1?s-1 |
| B、v(C)=0.5 mol?L-1?s-1 |
| C、v(B)=0.6 mol?L-1?s-1 |
| D、v(A)=0.15 mol?L-1?s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 化学反应中的热效应
化学反应中的热效应| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O,NaOH,Na2CO3,NaCl,Na2SO4,Na2O2都属于钠的含氧化合物 |
| B、简单非金属阴离子只有还原性,而金属阳离子不一定只有氧化性 |
| C、一种元素可能有多种氧化物,但同种化合价只对应有一种氧化物 |
| D、物质发生化学变化一定有化学键断裂与生成,并伴有能量变化,而发生物理变化就一定没有化学键断裂或生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com