
| A、物质的量浓度c(甲)是c(乙)的10倍 |
| B、溶液中的c(OH-)甲是乙的10倍 |
| C、由水电离产生的c(H+)乙是甲的10倍 |
| D、与等量的NaOH反应消耗甲、乙两酸的体积V(甲)>10V(乙) |
| Kw |
| c(H+) |
| Kw |
| c(H+) |


科目:高中化学 来源: 题型:
| A、NH3?H2O═NH4++OH- |
| B、H2CO3?CO32-+2H+ |
| C、NaHCO3═Na++H++CO32- |
| D、Al2(SO4)3═2Al3++3SO42- |
| E、Al2(SO4)3═2Al3++3SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al在氧气中燃烧生成Al2O3,将Al粉改为Al片 |
| B、Fe与稀盐酸反应制取H2时,加入少量醋酸钠粉末 |
| C、Na与水反应时增大水的用量 |
| D、Zn与稀硫酸反应时,适当提高溶液的温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
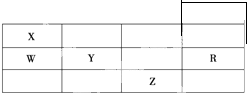 如图为元素周期表前4周期的一部分,下列有关R、W、X、Y、Z 5种元素的叙述中,正确的是( )
如图为元素周期表前4周期的一部分,下列有关R、W、X、Y、Z 5种元素的叙述中,正确的是( )| A、X、Z元素都能够形成双原子分子 |
| B、W、R元素单质分子内的化学键都是非极性键 |
| C、键长X-H<W-H,键能X-H<W-H |
| D、键能W-H>Y-H,键的极性Y-H>W-H |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、纯碱溶液去油污 |
| B、水中加入明矾可以净化水 |
| C、加热稀醋酸溶液其pH 稍有减小 |
| D、实验室配置FeCl3溶液时,加入少量HCl,以防止溶液浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀释前,溶液 pH:①>②=③ |
| B、稀释前,溶液中溶质的物质的量浓度:③>①=② |
| C、稀释后,溶液 pH:①>②=③ |
| D、稀释后,溶液中溶质的物质的量浓度:③>①=② |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com