

 ,
, 

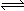 2NH3(g) △H= -90.8 kJ·mol-1(2分)
2NH3(g) △H= -90.8 kJ·mol-1(2分)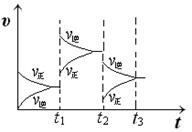
 2NH3(g) △H= -90.8 kJ·mol-1
2NH3(g) △H= -90.8 kJ·mol-1
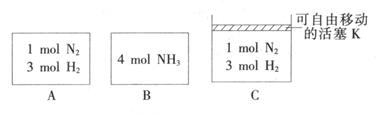
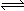 2NH3(g)
2NH3(g)

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源:不详 题型:填空题
 2NH3(g)ΔH=-92kJ/mol(表示当生成2 mol NH3时放出92.2KJ的热)。有关键能:N≡N:945.6kJ/mol ;N-H:391.0kJ/mol,则H—H键能为 KJ/mol
2NH3(g)ΔH=-92kJ/mol(表示当生成2 mol NH3时放出92.2KJ的热)。有关键能:N≡N:945.6kJ/mol ;N-H:391.0kJ/mol,则H—H键能为 KJ/mol查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.250 | 0.012 |
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1molCO 2molH2 | 1molCH3OH | 2molCH3OH | |
| 平衡数据 | CH3OH的浓度(mol/L) | c 1 | c 2 | c 3 |
| 反应的能量变化的绝对值(kJ) | a | b | c | |
| 体系压强(Pa) | P1 | P2 | P3 | |
| 反应物转化率 | α1 | α2 | α3 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.吸热88kJ | B.吸热2.44KJ | C.放热44kJ | D.吸热44KJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
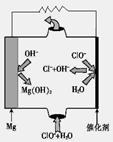
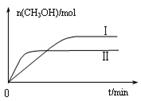
 CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H| 容 器 | 甲 | 乙 |
| 反应物 投入量 | 1molCO2 3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
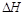 =______________。
=______________。 查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
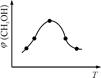
 2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.N2H4(g)+NO2(g)===3/2N2(g)+2H2O(g) ΔH=+567.85kJ·mol-1 |
| B.N2H4(g)+NO2(g)===3/2N2(g)+2H2O(g) ΔH=-567.85kJ·mol-1 |
| C.N2H4(g)+NO2(g)===3/2N2(g)+2H2O(l) ΔH=+567.85kJ·mol-1 |
| D.N2H4(g)+NO2(g)===3/2N2(g)+2H2O(l) ΔH=-567.85kJ·mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com