



 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
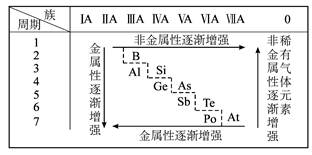
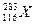 ,它属于一种新元素116号元素(元素符号暂用X代替),关于它的推测正确的是( )
,它属于一种新元素116号元素(元素符号暂用X代替),关于它的推测正确的是( )查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.X的原子序数比Y的小 | B.X原子的电子层数比Y的少 |
| C.X的原子半径比Y的小 | D.X元素的最高正价比Y的小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子序数为24 | B.最高价氧化物的化学式为SeO3 |
| C.非金属性比溴弱 | D.气态氢化物的化学式为H2Se |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.a-c="2n" | B.a-b="n-m" | C.c-d="m+n" | D.b-d=2n |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com