
电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示:
|
化学式 |
HF |
H2CO3 |
HClO |
|
电离平衡常数 (Ka) |
7.2×10-4 |
K1=4.4×10-7 K2=4.7×10-11 |
3.0×10-8 |
(1)已知25℃时,①HF(aq)+OH—(aq)=F—(aq)+H2O(l) ΔH=-67.7kJ/mol,
②H+(aq)+OH—(aq)=H2O(l) ΔH=-57.3kJ/mol ,
氢氟酸的电离方程式及热效应可表示为________________________。
(2)将浓度为0.1 mol/LHF溶液加水稀释一倍(假设温度不变),下列各量增大的是____。
A.c(H+) B.c(H+)·c(OH—) C. D.
D.
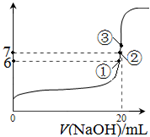
(3)25℃时,在20mL0.1mol/L氢氟酸中加入VmL0.1mol/LNaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是_____。

A.pH=3的HF溶液和pH=11的NaF溶液中, 由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中,c(F—)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(F—)=c(Na+)
D.③点时V=20mL,此时溶液中c(F—)< c(Na+)=0.1mol/L
(4)物质的量浓度均为0.1mol/L的下列四种溶液: ① Na2CO3溶液 ② NaHCO3溶液 ③ NaF溶液 ④NaClO溶液。依据数据判断pH由大到小的顺序是______________。
(5)Na2CO3溶液显碱性是因为CO32—水解的缘故,请设计简单的实验事实证明之
___________________________________________________________。
(6)长期以来,一直认为氟的含氧酸不存在。1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H—O—F。HFO与水反应得到HF和化合物A,每生成1molHF转移 mol电子。
(1)HF(aq)  H+(aq) +F—(aq) △H=-10.4KJ·mol—1(不写可逆号扣1分)(2)CD
H+(aq) +F—(aq) △H=-10.4KJ·mol—1(不写可逆号扣1分)(2)CD
(3)BC (4)①④②③(或①>④>②>③,用物质名称表示也对)(5)在碳酸钠溶液中滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去或变浅。(6)1
【解析】
试题分析:(1)利用盖斯定律将①-②可得,HF(aq)⇌F-(aq)+H+(aq)△H=-10.4 kJ•mol-1;(2)将浓度为0.1 mol/LHF溶液加水稀释一倍,c(H+)减小,根据水的离子积常数,c(OH—)增大,D选项正确。(3)A.酸碱抑制水的电离,盐促进水的电离,A选项错;B.根据电荷守恒,c(Na+)+c(H+)=c(F—)+c(OH—)此时溶液中, c(F—)-c(Na+)=c(H+)-c(OH—)=10-6-10-9=9.9×10-7mol/L ;C.根据电荷守恒和溶液呈中性,不难得到,溶液中的c(F—)=c(Na+);D.③点时V=20mL,此时酸碱溶液恰好完全反应,是氟化钠盐溶液,氟离子水解,溶液中c(F—)< c(Na+)=0.05mol/L。(4)酸越弱,所对应的盐溶液碱性越强;酸性:HF>H2CO3>HClO>HCO3- ,则所对应盐的碱性:Na2CO3溶液>NaClO溶液> NaHCO3溶液 >NaF溶液 ;(5)在碳酸钠溶液中滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去或变浅。(6)HFO的原子连接顺序为H-O-F(八隅律,最外电子均为8),H-O中电子偏向O,O呈-1,O-F电子偏向F(F电负性大于O),O呈+1,综合O的化合价为0,F的化合价-1。
考点:考查热化学方程式书写、盐类水解相关计算等知识。


科目:高中化学 来源: 题型:
 已知25℃时部分弱电解质的电离平衡常数数据如下表:
已知25℃时部分弱电解质的电离平衡常数数据如下表:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数 (Ka) |
7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 |
3.0×10-8 |
| c(H+) |
| c(HF) |
| c(OH-) |
| c(H+) |
查看答案和解析>>
科目:高中化学 来源:2013年全国普通高等学校招生统一考试理科综合能力测试化学(福建卷解析版) 题型:填空题
[化学—物质结构与性质]
(1)依据第2周期元素第一电离能的变化规律,参照下图B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置。

(2)NF3可由NH3和F2在Cu催化剂存在下反应直接得到:4NH3+3F2 NF3+3NH4F
NF3+3NH4F
①上述化学方程式中的5种物质所属的晶体类型有_________(填序号)。
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
②基态铜原子的核外电子排布式为________。
(3)BF3与一定量水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:

①晶体Q中各种微粒间的作用力不涉及___________(填序号)。
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.范德华力
②R中阳离子的空间构型为_______,阴离子的中心原子轨道采用_______杂化。
(4)已知苯酚( )具有弱酸性,其Ka=1.1 ×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1 ×10-10;水杨酸第一级电离形成的离子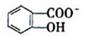 能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”),其原因是__________。
能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”),其原因是__________。
查看答案和解析>>
科目:高中化学 来源:2010—2011学年浙江省金华十校高二下学期期中考试化学试卷 题型:填空题
(9分)已知25℃时,CH3COOH和NH3·H2O的电离平衡常数分别为Ka(CH3COOH)=l.7×10-5mol/L,Kb(NH3·H2O)=1.7×l0-5mol/L。现有常温下1 mol/L的醋酸溶液和l mol/L的氨水,且知醋酸溶液的pH=a,试回答下列问题:
(1)醋酸溶液中存在的电离平衡用电离方程式表示为 ,
(2)将上述两种溶液等体积混合,所得溶液的pH= 。
(3)饱和氯化铵溶液显酸性,原因是(用离子方程式表示) ;向饱和氯化铵溶液中加入少量Mg(OH)2固体,固体完全溶解。甲、乙两位同学分别提出了不同的解释:
甲同学:由于NH4+水解呈酸性,其H+结合Mg(OH)2电离的OH-,使Mg(OH)2溶解
乙同学:由于Mg(OH)2 Mg2++2OH-,NH4++OH-
Mg2++2OH-,NH4++OH- NH3·H2O,使Mg(OH)2溶解。请你设计一个实验验证两位同学的解释 。
NH3·H2O,使Mg(OH)2溶解。请你设计一个实验验证两位同学的解释 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com