
 ,故答案为:
,故答案为: ;
;| 1mol×3 |
| 2 |


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
| A、C(SO42-)=C(Na+)>C(NH4+)>C(OH-)>C(H+) |
| B、C(Na+)>C(SO42-)>C(NH4+)>C(OH-)>C(H+) |
| C、C(NH4+)>C(SO42-)=C(Na+)>C(OH-)>C(H+) |
| D、C(H+)+C(NH4+)+C(Na+)=C(OH-)+C(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 编号 | HA物质的量 浓度(mol?L-1) | NaOH物质的量 浓度(mol?L-1) | 混合溶 液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
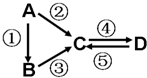 A、B、C、D均为常见的纯净物,A是单质.它们之间有如下的反应关系:
A、B、C、D均为常见的纯净物,A是单质.它们之间有如下的反应关系:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 药名 | 小苏打 | 胃舒平 | 达喜 |
| 化学式 | NaHCO3 | Al(OH)3 | Al2Mg6(OH)16CO3?4H2O |
| 每片药量 | 0.50g | 0.245g | 0.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2gH2所占有的体积是22.4L |
| B、11.2LO2的质量是16g |
| C、标准状况下,22.4LH2O含有6.02×1023个H2O分子 |
| D、常温下压下32gO2与标准状况下22.4LN2含有相同的分子数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com